
����Ŀ��Ŀǰ��ҵ�Ͽ���CO2������ȼ�ϼ״����йط�ӦΪ��
CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H����49.0 kJ��mol��1���������Ϊ1L���ܱ������У�����1molCO2��3molH2����Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH��g��+H2O��g�� ��H����49.0 kJ��mol��1���������Ϊ1L���ܱ������У�����1molCO2��3molH2����Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ��
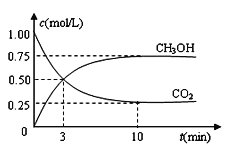
��1���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ��Ũ��ΪC��H2����_____________��
��2�����ı�����ʹƽ��������Ӧ�����ƶ�����ƽ�ⳣ��______________���������
a�����ܲ��� b�����ܼ�С c���������� d�����䡢��С��������п���
��3���ܹ�˵���÷�Ӧ�Ѵﵽƽ�����__________������ĸ���,��ͬ����
A.���¡�����ʱ,�����ڵ�ѹǿ���ٱ仯
B.���¡�����ʱ,�����ڻ��������ܶȲ��ٱ仯
C.һ��������,CO2��H2��CH3OH��Ũ�ȱ��ֲ���
D.һ��������,��λʱ��������3molH2��ͬʱ����1mol CH3OH
��4���������������������£�����ϵ���ѹ����ԭ���Ķ���֮һ�������йظ���ϵ��˵����ȷ����________��
a��������Ũ�ȼ�С b������Ӧ���������淴Ӧ����Ҳ����
c���״������ʵ������� d������ƽ��ʱn��H2��/n��CH3OH������
��5������¶���T���¸÷�Ӧ��ƽ�ⳣ��K= ________������ʼʱ���1L�ܱ������г���1mol CO2,2mol H2,1.5mol CH3OH��1mol H2O��g��,��Ӧ��________����������������������Ӧ������С�
���𰸡���1��0.75mol��L��1��2��ac��3��AC��4��bc��5��16/3��
��������
�����������1����ͼ��֪��10min����ƽ�⣬ƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L���ɷ���ʽCO2��g��+3H2��g��CH3OH��g��+H2O��֪��������Ũ�ȱ仯���ڼ״���Ũ�ȱ仯��Ϊ0.75mol/L��3=2.25mol/L����������ƽ��Ũ��ΪC��H2����3mol/1L-2.25mol/L=0.75mol/L��
��2����ѧƽ�ⳣ��ֻ���¶��йأ������ı��¶ȣ�ʹƽ�������ƶ�ʱ����ѧƽ�ⳣ�����䣬����Ӧ���ȣ��������¶�ʹƽ�������ƶ�ʱ����ѧƽ�ⳣ����С���ʴ�Ϊac��
��3��A.���巴Ӧ��������������ϵ���Ͳ��ȣ������¡�����ʱ,�����ڵ�ѹǿ���ٱ仯��˵����Ӧ�ﵽƽ��״̬����A��ȷ��B.��Ӧ��ϵ��Ϊ��̬�����������غ㶨�ɣ����¡�����ʱ,�����ڻ��������ܶ�ʼ�ձ��ֲ��䣬��һ����ƽ��״̬����B����C.һ��������,CO2��H2��CH3OH��Ũ�ȱ��ֲ���˵����Ӧ�ﵽƽ�⣬��C��ȷ��D.һ��������,��λʱ��������3molH2��ͬʱ����1molCH3OH������ʾ����Ӧ���ʣ����жϷ�Ӧ�ﵽƽ��״̬����D����ΪAC��
��4���������������������£�����ϵ���ѹ����ԭ���Ķ���֮һ����ʱ�����ʵ�Ũ��˲������һ����ƽ�����������ƶ�����Ӧ���Ũ�Ȼ����м�С���������Ũ�Ȼ��������a��������Ũ������a����b����������Ӧ������������b��ȷ�� c��ƽ�������ƶ����״������ʵ�����������c��ȷ��d��ƽ�������ƶ���n��H2����С��n��CH3OH����������ƽ��ʱn��H2��/n��CH3OH����С����d����Ϊbc��
��5��ƽ��ʱ�״�Ϊ0.75mol/L��������̼Ϊ0.25mol/L��H2Ϊ0.75mol/L��ˮҲΪ0.75mol/L����ƽ�ⳣ��K=![]() =16/3������ʼʱ���1L�ܱ������г���1mol CO2,2mol H2,1.5mol CH3OH��1mol H2O��g��,��ʱQ=
=16/3������ʼʱ���1L�ܱ������г���1mol CO2,2mol H2,1.5mol CH3OH��1mol H2O��g��,��ʱQ=![]() =��1.5��1��/��1��23��=3/16<K��˵����Ӧ������С�
=��1.5��1��/��1��23��=3/16<K��˵����Ӧ������С�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڵ�������ܵ������(����)
A. ͭ B. ���ڵ������
C. ����������Һ D. �Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������������������
��4HCl(Ũ)+MnO2![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��KClO3+6HCl=3Cl2��+KCl+3H2O
��KMnO4+HCl(Ũ)��KCl+MnCl2+Cl2��+H2O(δ��ƽ)��
��������������Ӧ���ش��й����⣺
(1)��Ӧ���������ӷ���ʽΪ________________��
(2)��Ӧ���У����������뻹ԭ�����������Ϊ____________��
(3)�뽫��Ӧ����ƽ��____KMnO4+____HCl(Ũ)=____KClʮ____MnCl2��____Cl2��+____H2O
(4)��Ҫ�Ƶ���ͬ��������������������Ӧ�е���ת�Ƶ���Ŀ֮��Ϊ___________��
(5)��֪��Ӧ����4HCl(g)+O2![]() 2Cl2+2H2O(g)���÷�ӦҲ���Ƶ���������MnO2��O2��KMnO4����������������ǿ������˳��Ϊ__________________��
2Cl2+2H2O(g)���÷�ӦҲ���Ƶ���������MnO2��O2��KMnO4����������������ǿ������˳��Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���ʵ������У�����������(����)
A. ��Һ����ʱ����Һ©���¶˹ܿڼ�˴������ձ��ڱ�
B. ����ʪ��ĺ�ɫʯ����ֽ���鰱��
C. ϡ��Ũ����ʱ������ʢ��Ũ������ձ���ֱ�Ӽ�����ˮ
D. �Թܿ��þƾ���ֱ�Ӽ��ȣ�Ҳ����ˮԡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������m gij���壬����˫ԭ�ӷ��ӹ��ɣ�����Ħ������ΪM g��mol��1���������ӵ�������NA��ʾ����
��1������������ʵ���Ϊ________mol��
��2������������ԭ������Ϊ________����
��3���������ڱ�״���µ����Ϊ____________L��
��4������������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��Ϊ____________ mol/L��
��5������������1 Lˮ�У������Ƿ�Ӧ��������Һ�����ʵ���������Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2�Ʊ��״����̿����漰��Ӧ���£�
��Ӧ����CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ��H1=��49.58 kJmol-1
CH3OH(g) +H2O(g) ��H1=��49.58 kJmol-1
��Ӧ����CO2(g)+ H2(g) ![]() CO (g)+H2O(g) ��H2
CO (g)+H2O(g) ��H2
��Ӧ����CO(g)+2 H2(g) ![]() CH3OH(g) ��H 3=��90.77 kJmol-1
CH3OH(g) ��H 3=��90.77 kJmol-1
�ش��������⣺
��1����Ӧ������H2= ����Ӧ���Է����������� ������¡��������¡����κ��¶ȡ�����
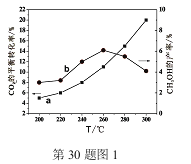
��2��ij�о�С�齫һ������H2��CO2��������ܱ������У��ں��ʵĴ��������·����˷�ӦI������������ͬ�¶�����ϵ�ﵽƽ��ʱ���CO2��ת���ʣ�a����CH3OH�IJ��ʣ�b���仯��ͼ1��ʾ��
���÷�Ӧ�ﵽƽ���Ϊ����߷�Ӧ����ͬʱ��״������������ɲ�ȡ�Ĵ�ʩ�� ��
A���ø�Ч���� B�����¶� C��С������� D������״� E����CO2��Ũ��
����ͼ1�����¶ȸ���260��ʱ��CO2��ƽ��ת�������¶ȵ����������ӣ���CH3OH�IJ���ȴ�����½�����˵������ ��
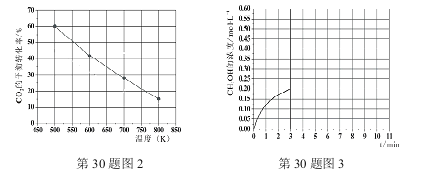
��3����֪����2L�����ܱ������г���3mol H2��1.5mol CO2��һ�������£������Ƿ�����Ӧ������ʵ�����ڲ�ͬ�¶��£���Ӧ��ϵ��CO2��ƽ��ת�������¶ȵĹ�ϵ������ͼ2��ʾ��ʵ���ã���500Kʱ����Ӧ����10minʱ�ﵽƽ�⣬���������������䣬����Ӧʱ����е�3minʱ��Ѹ�ٽ���Ӧ�¶�����600K����ʵ�飬����ͼ3�л���3��10min��������CH3OHŨ�ȵĺ����仯������ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵķ�����ȷ���ǣ� ��
A.������������Ȫˮ��ˮ��
B.�����������CO2��SO2��CO
C.�Σ������ơ��Ȼ�李�����
D.������ʣ�CH3COOH��H2O��NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��Ʒ����̼���Ƽ������������ƺ��Ȼ��ƣ�ijѧ��Ϊ�˼������е������ӣ�������ͼ�������ʵ�飬�����Լ������������ɹ�ѡ����Լ��У�ϡ���ᡢϡ���ᡢϡ���ᡢBaCl2��Һ��Ba(NO3)2��Һ��AgNO3��Һ��
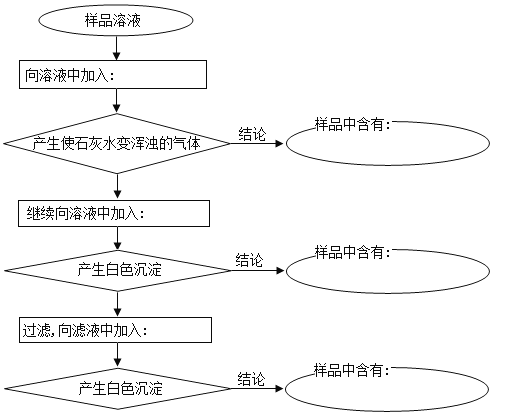
��1���뽫�����Լ����йؽ��۵Ļ�ѧʽ��д����Ӧ�Ŀո��С�
�� �� ��
�� �� ��
��2��д�������Լ�����Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե���̼���仯������о�������Ҫ���塣
��1������(N2H4��Ϊȼ�ϣ������������������������߷�Ӧ���ɵ�������̬ˮ��
��֪��N2(g��+2O2(g��=N2O4(g����H1K1
N2H4(g��+O2(g��=N2(g��2H2O(g����H2K2
��2N2H4(g��+ N2O4(g��=3N2(g��+ 4H2O(g�� ��H�� (����H1����H2��ʾ�����÷�Ӧ�Ļ�ѧƽ�ⳣ��K = (��K1��K2��ʾ��
��2������β��ת����Ӧ��NO��CO��N2��CO2(δ��ƽ��,��NO��COת��Ϊ��N2��CO2��ʵ�ֳ��ۣ�ÿ����1molN2��ԭ��ʧȥ������Ϊ ��
��3�� ������Ⱦ�ﵪ����������û���̿��ԭ��������ij�о�С����ij2L���ܱ������м���һ�����Ļ���̿��NO��������ӦC(s����2NO(g�� ![]() N2(g����CO2 (g������T1��ʱ����Ӧ���е���ͬʱ��(t����ø����ʵ����ʵ���(n������
N2(g����CO2 (g������T1��ʱ����Ӧ���е���ͬʱ��(t����ø����ʵ����ʵ���(n������
t(min�� n(mol�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.00 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
0~10min�ڣ�NO��ƽ����Ӧ����v(NO��= ��T1��ʱ���÷�Ӧ��ƽ������K= ��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��������жϸı������������ (����ĸ�������
a������һ�����Ļ���̿ b��ͨ��һ������NO
c������ʱ������һ�����ĺ��� d�����������Ĵ���
��4����ȼ�ϵ��ʹ�õĵ������Һ��2mol��L-1��KOH��Һ����ط�ӦΪ��4NH3+3O2=2N2+6H2O���ŵ�ʱ���õ�������ĵ缫��ӦʽΪ ��
��5��������Ϊ�жϷ�Ӧ�ﵽ��ѧƽ��״̬�������� (����ĸ�������
A��������CO2��Ũ�ȱ��ֲ���
B��v��(N2��=2v��(NO��
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
E����������ƽ����Է����������ֲ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com