
【题目】对氮、碳及其化合物的研究具有重要意义。
(1)用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g)△H1K1
N2H4(g)+O2(g)=N2(g)2H2O(g)△H2K2
则2N2H4(g)+ N2O4(g)=3N2(g)+ 4H2O(g) △H= (用△H1、△H2表示),该反应的化学平衡常数K = (用K1、K2表示)
(2)汽车尾气转化反应:NO+CO→N2+CO2(未配平),将NO和CO转化为和N2和CO2,实现除污,每生成1molN2还原剂失去电子数为 。
(3) 大气污染物氮氧化物可以用活性炭还原法处理。某研究小组向某2L的密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间(t)测得各物质的物质的量(n)如下
N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间(t)测得各物质的物质的量(n)如下
t(min) n(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.00 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
0~10min内,NO的平均反应速率v(NO)= ;T1℃时,该反应的平均常数K= 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.恒温时,充入一定量的氦气 d.加入适量的催化剂
(4)氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O,放电时,该电池正极的电极反应式为 。
(5)不能作为判断反应达到化学平衡状态的依据是 (填字母序号)。
A.容器内CO2的浓度保持不变
B.v正(N2)=2v逆(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
【答案】(1)2△H2—△H1(1分) K22/K1(1分)
(2)4NA或4×6.02X1023(2分)
(3)①0.042mol·L-1·min-1(2分) 0.56(或9/16)(2分) ②b(1分)
(4)O2+2H2O+4e-=4OH-(2分)
(5)BC(2分)
【解析】
试题分析:(1)已知:①N2(g)+2O2(g)=N2O4(g)△H1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2
根据盖斯定律,②×2-①可得:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),则△H=2△H2-△H1,该反应平衡常数K=K22/K1;
(2)反应中N元素化合价由+2价降低为0价,每生成1molN2还原剂失去电子数为1mol×4×6.02×1023mol-1=4×6.02×1023;
(3)①①0~10min内,NO的平均反应速率v(NO)=![]() =0.042mol/(L.min);
=0.042mol/(L.min);
由表中数据可知,20min时处于平衡状态,反应前后气体的体积不变,用物质的量代替浓度计算平衡常数,则K=![]() =9/16;②反应重新达到平衡,NO增大0.16mol,N2、CO2 均增大0.08mol,等于化学计量数之比,应是通入一定量的NO,故选b;
=9/16;②反应重新达到平衡,NO增大0.16mol,N2、CO2 均增大0.08mol,等于化学计量数之比,应是通入一定量的NO,故选b;
(4)氨燃料电池使用的电解质溶液是KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O.放电时,正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-;
(5)A.容器内CO2的浓度保持不变,可判断反应达到平衡状态,故A正确; B.v正(N2)=2v逆(NO),两速率比不等于化学计量数之比,反应没有达到平衡状态,故B正确;C.反应体系,气态反应物与气态生成物系数和相等,容器内压强保持不变,无法判断反应达到平衡状态,故C错误;D.反应体系中C为固体,则混合气体的密度保持不变,可知反应达到平衡状态,故C正确;E.反应体系中C为固体,气态反应物与气态生成物系数和相等,则混合气体的平均相对分子质量保持不变,可推知反应达到平衡状态,故E正确,答案为BC。


科目:高中化学 来源: 题型:
【题目】目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=—49.0 kJ·mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=—49.0 kJ·mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
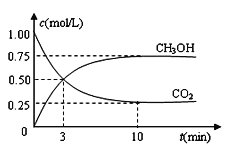
(1)从反应开始到平衡,氢气的平衡浓度为C(H2)=_____________;
(2)若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
a.可能不变 b.可能减小 c.可能增大 d.不变、减小、增大皆有可能
(3)能够说明该反应已达到平衡的是__________(填字母序号,下同)。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1mol CH3OH
(4)在其他条件不变的情况下,将体系体积压缩到原来的二分之一,下列有关该体系的说法正确的是________。
a.氢气的浓度减小 b.正反应速率增大,逆反应速率也增大
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(5)求此温度(T)下该反应的平衡常数K= ________。若开始时向该1L密闭容器中充入1mol CO2,2mol H2,1.5mol CH3OH和1mol H2O(g),则反应向________(填“正”或“逆”)反应方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于分液漏斗的使用,下列说法正确的是( )
A. 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质
B. 分液漏斗在使用前只需检查旋塞芯处是否漏水即可
C. 在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触
D. 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子.则该硫酸盐的物质的量浓度为
A.2 molL﹣1 B.7.5 molL﹣1 C.5 molL﹣1 D.2.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左移,恢复原温度后,活塞右移并停留于容器的中央,则原来H2、O2的体积比最接近于( )
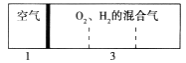
①2:7 ②5:4 ③4:5 ④7:2
A.①② B.③④ C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合气体由CH4和N2组成,测得混合气体在标准状况下的密度为0.893g/L,则混合气体中N2和CH4的体积之比为
A.1:2 B.1:4 C.2:1 D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境关系密切,下列说法正确的是
A. 明矾既能沉降水中的悬浮物,又能杀菌消毒
B. NH4Cl溶液可用作焊接时的除锈剂
C. 轮船船底四周镶嵌铜块以保护船体
D. 电解熔融氯化铝可以得到铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,下列说法正确的是
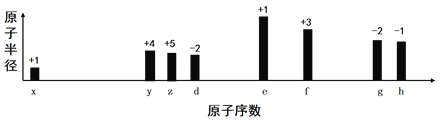
A. z和e的最高价氧化物对应的水化物能相互反应
B. 离子半径:f 3+>e+>d2-
C. g的气态氢化物含有非极性键
D. g的最高价氧化物和水反应生成的化合物是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,测得某Na2S和NH4Cl溶液的pH分别为10和5,则两溶液中水电离产生的c(H+)之比是
A. 1:5 B. 1:2 C. 1:10 D. 10:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com