
【题目】随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,下列说法正确的是
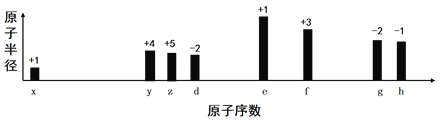
A. z和e的最高价氧化物对应的水化物能相互反应
B. 离子半径:f 3+>e+>d2-
C. g的气态氢化物含有非极性键
D. g的最高价氧化物和水反应生成的化合物是离子化合物
科目:高中化学 来源: 题型:
【题目】已知某样品含有碳酸钠及少量的硫酸钠和氯化钠,某学生为了检验其中的阴离子,按照右图程序进行实验,所加试剂均过量。(可供选择的试剂有:稀硫酸、稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液)
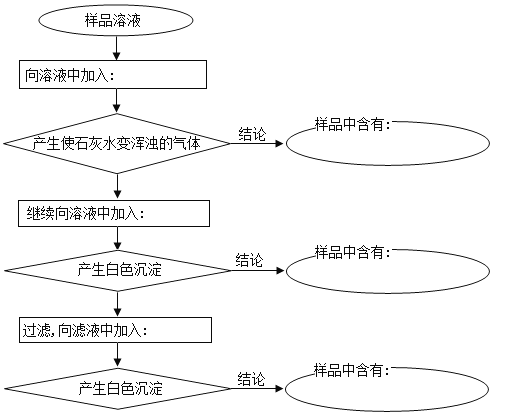
(1)请将所加试剂及有关结论的化学式填写在相应的空格中。
① ② ③
④ ⑤ ⑥
(2)写出加入试剂①反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氮、碳及其化合物的研究具有重要意义。
(1)用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g)△H1K1
N2H4(g)+O2(g)=N2(g)2H2O(g)△H2K2
则2N2H4(g)+ N2O4(g)=3N2(g)+ 4H2O(g) △H= (用△H1、△H2表示),该反应的化学平衡常数K = (用K1、K2表示)
(2)汽车尾气转化反应:NO+CO→N2+CO2(未配平),将NO和CO转化为和N2和CO2,实现除污,每生成1molN2还原剂失去电子数为 。
(3) 大气污染物氮氧化物可以用活性炭还原法处理。某研究小组向某2L的密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间(t)测得各物质的物质的量(n)如下
N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间(t)测得各物质的物质的量(n)如下
t(min) n(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.00 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
0~10min内,NO的平均反应速率v(NO)= ;T1℃时,该反应的平均常数K= 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.恒温时,充入一定量的氦气 d.加入适量的催化剂
(4)氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O,放电时,该电池正极的电极反应式为 。
(5)不能作为判断反应达到化学平衡状态的依据是 (填字母序号)。
A.容器内CO2的浓度保持不变
B.v正(N2)=2v逆(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究新制饱和氯水成份的实验中,根据实验现象得出的结论不正确的是( )
A. 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有CI-
C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D. 向淀粉碘化钾溶液中滴加少量氯水,溶液变蓝,说明氯水中含有ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于吸热反应的说法,错误的是
A. 需要加热的反应不一定是吸热反应
B. 多数分解反应是吸热反应
C. 吸热反应一定不能自发进行
D. 盐类的水解反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示的是A-E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。试推出各物质的化学式,并写出B→C、C→D、D→E、A→C反应的离子方程式。
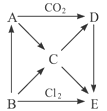
(1)A B C D
(2)B→C
(3)C→D
(4)D→E
(5)A→C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.0 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
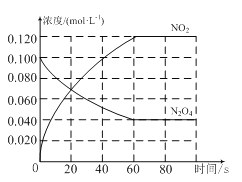
(1)反应的ΔH________0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为_______mol·L-1·s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________。
②列式计算温度T时反应的平衡常数K2:________________________。
(3)温度T时反应达平衡后,将反应容器的容积缩小到一半,平衡向________(填“正反应”或“逆反应”)方向移动,再次达到平衡后,NO2的浓度 (填“增大”或“缩小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CH(CH2CH3)3的名称是3-甲基戊烷
B.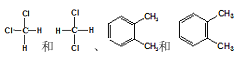 都属于同一种物质
都属于同一种物质
C.乙醛和丙烯醛(![]() )不是同系物,与氢气充分反应后产物也不是同系物
)不是同系物,与氢气充分反应后产物也不是同系物
D.向苯中加入酸性高锰酸钾溶液震荡后静置,观察到液体分层,且上、下层均无色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com