
【题目】在容积为1.0 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
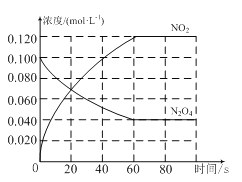
(1)反应的ΔH________0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为_______mol·L-1·s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________。
②列式计算温度T时反应的平衡常数K2:________________________。
(3)温度T时反应达平衡后,将反应容器的容积缩小到一半,平衡向________(填“正反应”或“逆反应”)方向移动,再次达到平衡后,NO2的浓度 (填“增大”或“缩小”)。
【答案】(1)大于 0.001 0 0.36 mol·L-1
(2)①大于 反应正方向吸热,反应向吸热方向进行,故温度升高
②平衡时,c(NO2)=0.120mol·L-1+0.0020mol·L-1·s-1×10s×2=0.160mol·L-1
c(N2O4)=0.040mol·L-1-0.0020mol·L-1·s-1×10s=0.020mol·L-1
K2=![]() =1.28mol·L-1
=1.28mol·L-1
(3)逆反应 增大
【解析】
试题分析:(1)温度升高,混合气体的颜色变深,说明升高温度,平衡向生成二氧化氮的方向移动,所以平衡正向移动,则正向是吸热反应,ΔH>0;在0~60s时段,N2O4的物质的量浓度从0.100mol/L减少到0.040mol/L,所以反应速率v(N2O4)=(0.100-0.040)mol/L/60s=0.001 mol·L-1·s-1;平衡时c(N2O4)=0.040mol/L,c(NO2)=0.120mol/L,所以100℃的平衡常数K=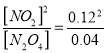 =0.36 mol·L-1;
=0.36 mol·L-1;
(2)①c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,说明平衡正向移动,则温度升高,T>100℃;因为正反应是吸热反应,温度升高,平衡才向正向移动;
②c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡,则10s后达到平衡时的c(N2O4)=0.040mol/L-0.0020mol·L-1·s-1×10s=0.02mol/L,则此时c(NO2)=0.120mol/L+2×0.02mol/L=0.16mol/L,所以T温度的平衡常数K=![]() =1.28mol·L-1。
=1.28mol·L-1。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,则压强增大,平衡逆向移动,因为增大压强,平衡向气体物质的量减少的方向移动,而逆向是气体的物质的量减少的方向,所以平衡逆向移动。


科目:高中化学 来源: 题型:
【题目】关于分液漏斗的使用,下列说法正确的是( )
A. 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质
B. 分液漏斗在使用前只需检查旋塞芯处是否漏水即可
C. 在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触
D. 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境关系密切,下列说法正确的是
A. 明矾既能沉降水中的悬浮物,又能杀菌消毒
B. NH4Cl溶液可用作焊接时的除锈剂
C. 轮船船底四周镶嵌铜块以保护船体
D. 电解熔融氯化铝可以得到铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,下列说法正确的是
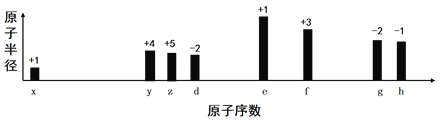
A. z和e的最高价氧化物对应的水化物能相互反应
B. 离子半径:f 3+>e+>d2-
C. g的气态氢化物含有非极性键
D. g的最高价氧化物和水反应生成的化合物是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容量瓶是一种定量仪器,其瓶身上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥密度
这六项中的( )
A.②④⑥
B.③⑤⑥
C.①②④
D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应条件的控制中不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率,加入MnO2
D.为提高H2O2的分解率, 向溶液中滴加FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列有关化学基本概念的依据正确的是 ( )
A. 溶液与胶体:不同的本质原因是能否发生丁达尔效应
B. 纯净物与混合物:是否仅含有一种元素
C. 氧化还原反应:元素化合价是否变化
D. 电解质与非电解质:物质本身的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,测得某Na2S和NH4Cl溶液的pH分别为10和5,则两溶液中水电离产生的c(H+)之比是
A. 1:5 B. 1:2 C. 1:10 D. 10:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH+4、Fe2+、Fe3+、CO2-3、SO2-3、SO2-4、Cl-、NO-3中的一种或几种,取该溶液进行连续实验,实验内容如下:
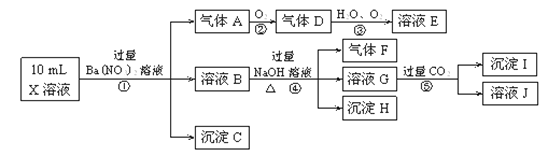
根据以上信息,回答下列问题:
(1)反应③的化学方程式为________________________。
(2)沉淀C、H和气体F的化学式分别为____________________。
(3)写出有关反应的离子方程式:
①中生成A_____________________。⑤________________________。
(4)上述离子中,溶液X中肯定不含有的离子是_______________,可能含有的离子是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com