
【题目】某强酸性溶液X含有Ba2+、Al3+、NH+4、Fe2+、Fe3+、CO2-3、SO2-3、SO2-4、Cl-、NO-3中的一种或几种,取该溶液进行连续实验,实验内容如下:
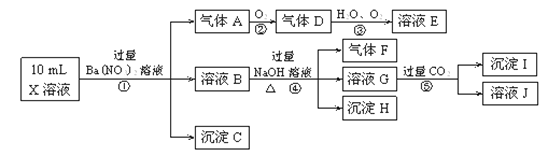
根据以上信息,回答下列问题:
(1)反应③的化学方程式为________________________。
(2)沉淀C、H和气体F的化学式分别为____________________。
(3)写出有关反应的离子方程式:
①中生成A_____________________。⑤________________________。
(4)上述离子中,溶液X中肯定不含有的离子是_______________,可能含有的离子是___________。
【答案】
(1)4NO2+O2+2H2O=4HNO3;
(2)BaSO4、Fe(OH)3、NH3;
(3)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)NO3-、Ba2+、CO32-、SO32-;Cl-、Fe3+。
【解析】
试题分析:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀H为Fe(OH)3,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液G中通入CO2气体,生成沉淀I,则I为Al(OH)3,G为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-。
(1)由以上推断可知,D为NO2,E为HNO3,反应③的化学方程式为:4NO2+O2+2H2O=4HNO3,故答案为:4NO2+O2+2H2O=4HNO3;
(2)由以上推断可知,沉淀C为BaSO4沉淀,沉淀H为Fe(OH)3,气体F为NH3,故答案为:BaSO4、Fe(OH)3、NH3;
(3)①Fe2+离子被氧化为Fe3+离子,NO3-离子被还原为NO气体,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
②G为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)通过以上分析可知,X中肯定含有:Al3+、NH4+、Fe2+、SO42-;可能含有Fe3+、Cl-;一定没有:Ba2+、CO32-、SO32-、NO3-;故答案为:Ba2+、CO32-、SO32-、NO3-;Fe3+、Cl-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在容积为1.0 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
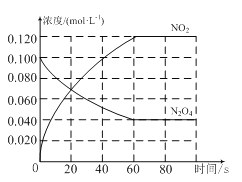
(1)反应的ΔH________0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为_______mol·L-1·s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________。
②列式计算温度T时反应的平衡常数K2:________________________。
(3)温度T时反应达平衡后,将反应容器的容积缩小到一半,平衡向________(填“正反应”或“逆反应”)方向移动,再次达到平衡后,NO2的浓度 (填“增大”或“缩小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于吸热反应的说法,正确的是( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.吸热反应一定不能自发进行
D.盐类的水解反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作正确的是
A. pH试纸直接蘸取NaOH溶液测定其pH
B. 存放化学品的仓库失火后,尽快用水灭火
C. 蒸馏时,加热一段时间后,再投入沸石
D. 切割剩下的白磷放回原试剂瓶水封保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 4molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)![]() 2C(g),若经 2s后测得C的浓度为 0.6molL-1,现有下列几种说法:
2C(g),若经 2s后测得C的浓度为 0.6molL-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3molL-1s-1
②物质 B的体积分数是40%
③2s 时物质 A 的转化率为30%
④2s 时物质 B 的浓度为 1.0molL-1
其中正确的是( )
A. ①④ B. ①③ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将某种金属分别与等体积的甲、乙两种溶液反应,所加金属的质量与相同条件下产生气体的体积关系如图所示,下列推论可能正确的是( )
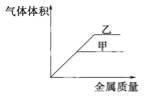
A.金属是镁,甲溶液为0.2mol/L盐酸,乙溶液为0.1mol/L盐酸
B.金属是铁,甲溶液为pH=1的醋酸溶液,乙溶液为pH=1的盐酸
C.金属是铝,甲溶液为0.1mol/L盐酸,乙溶液为0.1mol/L氢氧化钠溶液
D.金属是铝,甲溶液为0.1mol/L氢氧化钠溶液,乙溶液为0.1mol/L盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com