
【题目】下列关于SO2的说法中,不正确的是( )
A. SO2是酸性氧化物
B. SO2是形成酸雨的主要污染物之一
C. SO2与水反应生成H2SO4
D. 高温下SO2可被催化氧化生成SO3
科目:高中化学 来源: 题型:
【题目】下列实验中,①pH试纸的使用 ②过滤 ③蒸发 ④配制一定物质的量浓度溶液,均用到的仪器是
A. 蒸发皿 B. 玻璃棒 C. 试管 D. 分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:t℃下的某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:![]() ,有关该平衡的说法中正确的是( )
,有关该平衡的说法中正确的是( )
A.升高温度,平衡常数K变大
B.增大压强,W(g)物质的量分数变大
C.升温,若混合气体的平均相对分子质量变小,则正反应放热
D.增大X浓度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)过氧化钠保存不当容易变质,生成Na2CO3。判断过氧化钠在空气中是否变质的简单方法是观察颜色是否 。
(2)某过氧化钠样品已经部分变质,可以取少量样品,溶解,加入 溶液,充分振荡,看是否有白色沉淀,通过判断溶液中含有碳酸根来证明Na2O2已经变质
(3)检验样品中还有过氧化钠的方法是:取少量样品放入试管中,再加入适量的水,用 ,通过验证反应产生了氧气来证明样品中仍有Na2O2
(4)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
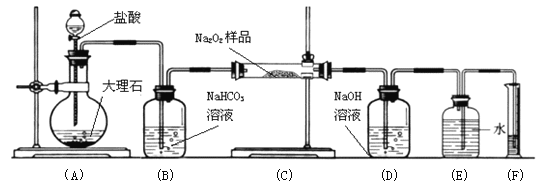
上图中的E和F构成量气装置,用来测定O2的体积。
写出装置A中发生反应的离子方程式:
装置B的作用是除去混在二氧化碳中的氯化氢气体,
NaOH的作用是
他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。
(1)若将W g Na2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定达到终点的现象是_________________。
(2)写出KMnO4与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2的化学方程式:________________________。
(3)25℃时,用pH计测得0.10 mol·L-1草酸钠溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2= 。
(4)CaC2O4是难溶于水的固体,受热易分解,在一定温度下向2L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应: CaC2O4(s)![]() CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为16.8g,则该段时间内υ(CO)=__________mol·L-1·s-1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号)。
CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为16.8g,则该段时间内υ(CO)=__________mol·L-1·s-1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号)。
A.平衡不移动,CaO的质量不变
B.平衡发生移动,当CO的百分含量不变时达到新的平衡
C.平衡发生移动,但CO和CO2的浓度都没有改变
D.平衡向逆反应方向移动,且该反应的化学平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。

(1)A装置的作用是____________________________。
(2)B装置的作用是____________________________。
(3)C装置的作用是___________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为__________________。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进________________。为什么?_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10 s末,硫酸的浓度减少了0.6 mol/L,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是( )
A.0.02 mol/(L·s) B.1.8 mol/(L·s)
C.1.2 mol/(L·s) D.0.18 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对第n电子层,若它作为原子的最外层,则容纳的电子数最多与(n-1)层的相同;当它作为次外层,则其容纳的电子数比(n+1)层上电子数最多能多10个,那么第n层为:
A. L层 B. M层 C. N层 D. 任意层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com