如图1是元素周期表的一部分.
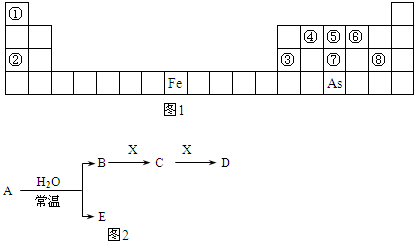
Ⅰ.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为
Clˉ>O2ˉ>Na+
Clˉ>O2ˉ>Na+
.
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
HClO4>H3PO4>H2CO3
HClO4>H3PO4>H2CO3
.
(3)As的原子结构示意图为
;其氢化物的化学式为
AsH3
AsH3
.
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂.As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
5NaClO+2As+3H2O═2H3AsO4+5NaCl
5NaClO+2As+3H2O═2H3AsO4+5NaCl
,当消耗1mol还原剂时,电子转移了
5
5
mol.
Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图2所示转化关系(部分生成物和反应条件略去).
若常温下A为红棕色气体,B为强酸,X为常见金属单质
(5)A与水反应的化学方程式为
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.
(6)工业上常用热还原法冶炼X,写出其化学方程式
.
(7)某温度下(>100℃)若m克X与H
2O反应放出QKJ (Q>O)的热量.写出该反应的热化学方程式
3Fe(s)+4H
2O(g)═Fe
3O
4(s)+4H
2(g)△H=-
kJ/mol
3Fe(s)+4H
2O(g)═Fe
3O
4(s)+4H
2(g)△H=-
kJ/mol
.
(8)少量X与B的稀溶液反应生成C的离子反应方程式为
Fe+4H++NO3ˉ=Fe3++NO↑+2H2O
Fe+4H++NO3ˉ=Fe3++NO↑+2H2O
.




 ,最低价位-3价,则氢化物为AsH3,
,最低价位-3价,则氢化物为AsH3, ;AsH3;
;AsH3;