
已知某溶液中c(Na+)=0.2 mol/L,c(Mg2+)=0.25 mol/L,c(Cl-)=0.4 mol/L,如果溶液中还有SO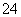 ,那么c(SO
,那么c(SO )应为( )
)应为( )
A.0.1 mol/L B.0.3 mol/L C.0.15 mol/L D.0.5 mol/L
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是( )
⑴Cl2+2KI=2KCl+I2; ⑵2FeCl2+Cl2=2FeCl3;
⑶2FeCl3+2HI=2FeCl2+2HCl+I2,⑷H2S+I2=S+2HI;
A. S>I2>Fe3+>Cl2 B. Cl2>Fe3+>I2>S
C. Fe3+>Cl2>S>I2 D. Cl2>I2>Fe3+>S
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上由黄铜矿(主要成分CuFeS2)除冶炼铜外,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为:
8CuFeS2+21O2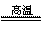 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 、 (填元素符号)。
⑵上述冶炼过程产生大量SO2 ,可选用下列试剂中的_____________吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.用稀H2SO4浸泡炉渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在____________(填离子符号),检验溶液中还存在Fe2+的方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A.①和② B.①和④ C.③和④ D.①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.1 mol H2O的质量为18g/mol B.3.01×1023个SO2分子的质量为32g
C.CH4的摩尔质量为16g D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
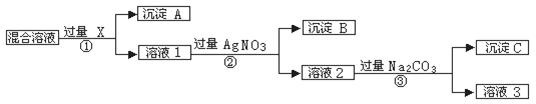
请回答下列问题:
⑴写出实验流程中下列物质的化学式: 试剂X : ,沉淀A: ,沉淀B: 。
⑵上述实验流程中加入过量的Na2CO3的目的是
⑶按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A、把盛有溶液的分液漏斗放在铁架台的铁圈中;
B、把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞;
C、检验分液漏斗活塞和上口玻璃塞是否漏液;
D、倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E、放开活塞,用烧杯接收溶液;
F、从分液漏斗上口倒出上层水溶液;
G、将漏斗上口的玻璃塞打开,或使塞上的凹槽对准漏斗口上的小孔;
H、静置、分层。
就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填空):
_____→ _____→ _____ → A → G →_____→ E →
(2)上述E步骤的操作中应注意 ; 上述G步骤操作的目的是 。
(3)能选用CCl4从碘水中萃取碘的原因是__ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
计算题(8分)恒温下,将a mol N2与b mol H2的混合气体通入一个容积为2L的密闭容器中,发生如下反应: N2 (g) + 3 H2(g)  2NH3(g);若反应进行到5min时,测得n (N2) = 13mol,n (NH3) = 6mol,计算a值、N2的起始浓度及用H2表示的反应速率(要有计算过程)。
2NH3(g);若反应进行到5min时,测得n (N2) = 13mol,n (NH3) = 6mol,计算a值、N2的起始浓度及用H2表示的反应速率(要有计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com