
ij��ѧ����С���ú���Ϊԭ����ȡ��������ˮ������CCl4�ӵ�ˮ����ȡ�Ⲣ�÷�Һ©������������Һ����ʵ������ɷֽ�Ϊ���¼�����
����A����ʢ����Һ�ķ�Һ©����������̨����Ȧ�У�
����B����50 mL��ˮ��15 mL CCl4�����Һ©���У����Ǻò�������
����C�������Һ©���������Ͽڲ������Ƿ�©Һ��
����D����ת©������������ʱ�����������������رջ������ѷ�Һ©��������
����E���ſ����������ձ�������Һ��
����F���ӷ�Һ©���Ͽڵ����ϲ�ˮ��Һ��
����G����©���ϿڵIJ���������ʹ���ϵİ��۶�©�����ϵ�С�ף�
����H�����á��ֲ㡣
���ʹ�ʵ�飬���������գ�
��1����ȷ���������˳���ǣ��������������ı����ĸ��գ���
����������_____�� _____�� _____ ����A������G����_____����E������
��2������E����IJ�����Ӧע�� �� ����G���������Ŀ���� ����
��3����ѡ��CCl4�ӵ�ˮ����ȡ���ԭ����__ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijͬѧ��NaHCO3��KHCO3��ɵ�ij��������ʵ�飬�����������(��������ʵ���Ũ�����)��
| 50 mL���� | 50 mL���� | 50 mL���� | |
| m(�����) | 9.2 g | 15.7 g | 27.6 g |
| V(CO2) (��״��) | 2.24 L | 3.36 L | 3.36 L |
�����з�����������ȷ����
A����������ʵ���Ũ��Ϊ3.0 mol/L
B�����ݱ��������ܼ�����������NaHCO3����������
C����������9.2 gʱ�������
D��15.7 g�����ǡ����������ȫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪ij��Һ��c(Na��)��0.2 mol/L��c(Mg2��)��0.25 mol/L��c(Cl��)��0.4 mol/L�������Һ�л���SO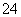 ����ôc(SO
����ôc(SO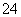 )ӦΪ(����)
)ӦΪ(����)
A��0.1 mol/L B��0.3 mol/L C��0.15 mol/L D��0.5 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
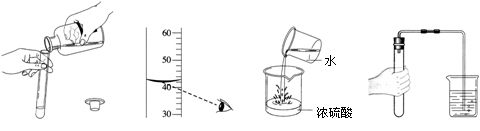 ����ʵ���������ȷ���ǣ�������
����ʵ���������ȷ���ǣ�������
A���㵹Һ�� B����ȡҺ����� C��ϡ��Ũ���� D�����װ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йذ����ӵ�����(NA)��˵��������ǣ� ����
A��0.5 mol H2O���е�ԭ����ĿΪ1.5 NA B��32 g O2������ԭ����ĿΪNA
C��1 mol H2O���е�H2O������ĿΪNA D��0.5 NA���������ӵ����ʵ�����0.5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ʵ�����CH4��NH3��Ƚϣ����н��۴������
A�����ǵķ��Ӹ�����Ϊ1��1 B�����ǵ�ԭ�Ӹ�����Ϊ5��4
C�����ǵĵ�������Ϊ1��1 D�����ǵ����������Ϊ3��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25�桢101 kPa�£�̼������������������ǵ�ȼ����������393.5 kJ/mol��285.8 kJ/mol��890.3 kJ/mol��2800 kJ/mol���������Ȼ�ѧ����ʽ��ȷ����
A��C(s)+1/2O2(g)=CO(g) ��H= -393.5 kJ/mol
B��2H2(g)+O2(g)=2H2O(l) ��H= -571.6 kJ/mol
C��CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H= +890.3 kJ/mol
D��C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(g) ��H= -2800 kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com