
| 压强 | MPa | 15.2 | 20.3 | 30.4 | 40.5 |
| 温 度 | 400℃ | 32.8 | 38.8 | 48.2 | 55.4 |
| 450℃ | 22.4 | 27.5 | 35.9 | 42.9 | |
| 500℃ | 14.9 | 18.8 | 25.8 | 31.9 | |
| 550℃ | 9.90 | 12.8 | 18.2 | 23.2 |
| C(NH3) |
| C(N2)1/2?c(H2)3/2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
A、CO2的电子式 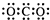 | ||
B、Cl-的结构示意图  | ||
| C、硫离子的核外电子排布式1s22s63s23p4 | ||
D、质量数为37的氯原子
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgO、Al2O3、SiO2 |
| B、硫酸钾、碳酸钾、硫酸铝三种溶液 |
| C、氯化镁、氯化铝、氯化钠三种溶液 |
| D、硫酸铵、硝酸铵、氯化铵三种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P2>P1<P3 |
| B、P2>P3>P1 |
| C、P2>P1>P3 |
| D、P2>P1=P3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A、2p2<p3 |
| B、a+b=184.8 |
| C、2c1<c3 |
| D、a1+a3>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H2和C2H6 |
| B、C2H2和C3H8 |
| C、CH4和C2H4 |
| D、C2H2和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、异秦皮啶与秦皮素互为同系物 |
| B、异秦皮啶分子式为C11H10O5 |
| C、鉴别异秦皮啶与秦皮素可用FeCl3溶液 |
| D、1mol的秦皮素最多可与4molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com