
A、CO2的电子式 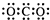 | ||
B、Cl-的结构示意图  | ||
| C、硫离子的核外电子排布式1s22s63s23p4 | ||
D、质量数为37的氯原子
|
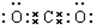 ,故A错误;
,故A错误; ,故B正确;
,故B正确;37 17 |


科目:高中化学 来源: 题型:
A、Na2O2电子式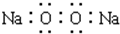 | ||
B、中子数为14的硅原子:
| ||
| C、二氧化硅的分子式SiO2 | ||
| D、乙烯的结构简式CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
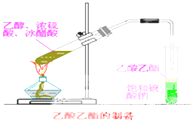 0.2mol某一元醇,在密闭容器中燃烧后,其产物为CO2、CO、H2O.产物通过浓H2SO4后,浓H2SO4增重10.8g;再通过灼热的CuO充分反应后,CuO失重3.2g;最后通过碱石灰,碱石灰增重17.6g.
0.2mol某一元醇,在密闭容器中燃烧后,其产物为CO2、CO、H2O.产物通过浓H2SO4后,浓H2SO4增重10.8g;再通过灼热的CuO充分反应后,CuO失重3.2g;最后通过碱石灰,碱石灰增重17.6g.查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图如图所示,回答下列问题:
工业上可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35.5:108 |
| B、l:2 |
| C、108:35.5 |
| D、8:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以他们的含量是空气质量报告的主要项目 |
| B、严格讲,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收 |
| C、开发利用新能源,合理利用工业生产的废热,是缓解能源危机的重要途径 |
| D、用二氧化硫、亚硝酸钠、苏丹红等化学药品“美化”后的食物“味美、色艳”,但添加剂超标,对人体危害极大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.60L |
| B、6.72L |
| C、4.48L |
| D、3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强 | MPa | 15.2 | 20.3 | 30.4 | 40.5 |
| 温 度 | 400℃ | 32.8 | 38.8 | 48.2 | 55.4 |
| 450℃ | 22.4 | 27.5 | 35.9 | 42.9 | |
| 500℃ | 14.9 | 18.8 | 25.8 | 31.9 | |
| 550℃ | 9.90 | 12.8 | 18.2 | 23.2 |
| C(NH3) |
| C(N2)1/2?c(H2)3/2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com