
【题目】已知常温下H2的密度是0.893gL-1。某烧杯中加入50.0mL水,并放入一小块金属钠,反应完全后冷却称量所得溶液,其质量为52.2g。试求:
(1)加入的钠的质量;
(2)所得H2在常温下的体积;
(3)所得溶液中NaOH的质量分数。
【答案】(1)2.3g;(2)0.11L(或1.1×102mL);(3)0.077(7.7%)
【解析】
试题分析:(1)Na和水反应方程式为2Na+2H2O═2NaOH+H2↑,反应前后溶液质量增加量=钠的质量-氢气质量,设参加反应的Na的质量为x,
2Na+2H2O═2NaOH+H2↑△m
46 44
X 52.2g-50.0g=2.2g
46:44=x:2.2g,x=![]() =2.3g,答:参加反应的Na的质量为2.3g;
=2.3g,答:参加反应的Na的质量为2.3g;
(2)n(Na)=![]() =0.1mol,根据转移电子守恒得生成n(H2)=
=0.1mol,根据转移电子守恒得生成n(H2)=![]() =0.05mol,V(H2)=
=0.05mol,V(H2)=![]() =
=![]() =0.112L,答:所得氢气在常温下体积为0.112L;
=0.112L,答:所得氢气在常温下体积为0.112L;
(3)根据原子守恒得n(NaOH)=n(Na)=0.1mol,m(NaOH)=nM=0.1mol×40g/mol=4g,溶液中NaOH质量分数=![]() ×100%=
×100%=![]() ×100%=7.7%,答:溶液中氢氧化钠的质量分数为7.7%。
×100%=7.7%,答:溶液中氢氧化钠的质量分数为7.7%。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
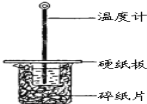
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;

(4)若将V1mL1.0molL-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①0.001 mol/L的A溶液pH=3;
②B溶液和D溶液显碱性,等浓度两者PH关系B< D;
③E是弱电解质。回答下列问题:
(1)D是____________溶液,判断理由是______________________。
(2)用水稀释0.1 mol·L-1 B时,溶液中随着水量的增加而减小的是________(填写序号)。
①![]() ②
②![]() ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
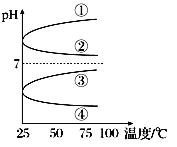
(3)将等体积、等物质的量浓度B和C的溶液混合,升高温度(溶质不会分解)溶液pH随温度变化为图中的________曲线(填写序号)。
(4)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌的物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌剩余 ⑥E溶液里有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层的破坏导致紫外线对地球表面辐射量的增加,从而使全球皮肤癌的发病人数明显增加。造成这一现象的主要原因是( )
A.人们大量使用氟氯烷烃
B.人们在炼钢时向空气中排放了大量的高炉煤气
C.石油炼制厂排放了大量的甲烷、氢气
D.硝酸、硫酸工厂排放了大量的二氧化硫和一氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①空气 ②O2 ③NaHSO4 ④氨水 ⑤CuSO45H2O ⑥NaOH ⑦CO2 ⑧Fe2O3 ⑨金刚石 ⑩H2SO4 , 请回答下列问题(请在横线上填写序号):
(1)属于混合物的有;
(2)属于酸性氧化物的有;
(3)属于碱的有;
(4)属于盐的有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A.在500 mL容量瓶中配制500 mL烧碱溶液 |
B.用移液管(或碱式滴定管)量取50.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂 |
C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解 |
D.将物质的量浓度为c mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1mL |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL 请完成下列问题:
(1)正确的操作步骤是(填写字母)________→________→________→D→________.
(2)滴定管读数应注意_______________________.
(3)操作中锥形瓶下垫一张白纸的作用是___________________.
(4)操作D中液面应调整到________________________;尖嘴部分应____________.
(5)滴定到终点时锥形瓶内溶液的pH约为___________;终点时的颜色变化是________.
(6)若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响________(填“偏高”、“偏低”或“无影响”,其他操作均正确).
(7)该烧碱样品的纯度计算式是__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当有人出现水杨酸反应(头痛、眩晕、恶心、耳鸣)时,医生可采取在静脉中注射下列哪种物质( )
A.1.25%NH4Cl B.0.9%NaHCO3 C.75%酒精 D.10%的青霉素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Ag+、Na+、Cl﹣、K+
B.Na+、Cu2+、SO42﹣、NO3﹣
C.Mg2+、Na+、SO42﹣、Cl﹣
D.Ba2+、HCO3﹣、NO3﹣、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com