
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
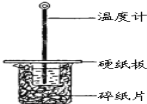
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;

(4)若将V1mL1.0molL-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
【答案】(1)D (2)ABD (3)ΔH1>ΔH2=ΔH3 (4)1.5mol/L
【解析】
试题分析:(1)A.该实验也可在保温杯中进行,A正确;B.图中实验装置缺少环形玻璃搅拌棒,B正确;C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失,C正确;D.若将盐酸体积改为60mL,两次实验所求得中和热相等,D错误,答案选D。
(2)A.实验装置保温、隔热效果差,导致热量损失,测量值减小,A正确;B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中导致热量损失,测量值减小,B正确;C.量取NaOH溶液的体积时仰视读数,实际量取的体积增加,测量值偏大,C错误;D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度,导致氢氧化钠减少,放出的热量减少,测量值减小,D正确。答案选ABD。
(3)弱电解质中才电离平衡,电离吸热,所以实际放出的热量减少,放热越少,△H越大,则ΔH1、ΔH2、ΔH3的大小关系为ΔH1>ΔH2=ΔH3;
(4)温度最高时说明二者恰好完全反应,所以氢氧化钠的浓度为![]() =1.5mol。
=1.5mol。


科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法正确的是
A. 淀粉水解与纤维素水解得到的最终产物不相同
B. 蛋白质、纤维素、蔗糖、油脂都是高分子化合物
C. 乙酸和油脂都能与NaOH溶液反应
D. 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,错误的是

A.装置①可用于电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等气体
C.装置③可用于检查乙炔的还原性
D.装置④可用于干燥、收集氨气、并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然橡胶在硫化前受热易熔化、发粘,弹性差,硫化后硬度增大,弹性变好,不易老化。硫化前后,橡胶( )
A.由链状分子变成网状分子 B.由大分子变为小分子
C.由小分子变成大分子 D.由有机物变成无机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组混合物的分离或提纯方法不正确的是( )
A.用加热法分离碘和氯化铵的混合物(提示:碘易升华,氯化铵受热易分解,冷却后它们又都重新生成原固体)
B.用结晶法提纯NaCl和KNO3混合物中的KNO3
C.用蒸馏法分离乙醇和水的混合物
D.用分液的方法分离煤油和NaCl溶液的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下现象与电化腐蚀无关的是( )
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B. 生铁比软铁芯(几乎是纯铁)容易生锈
C. 铁质器件附有铜质配件,在接触处易生铁锈
D. 银制奖牌久置后表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:

下列说法不正确的是( )
A.该过程中CeO2为H2O、CO2转变为H2、CO的催化剂
B.该过程实现了太阳能向化学能的转化
C.1molCeO2参加反应,共生成2x mol的气体
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下H2的密度是0.893gL-1。某烧杯中加入50.0mL水,并放入一小块金属钠,反应完全后冷却称量所得溶液,其质量为52.2g。试求:
(1)加入的钠的质量;
(2)所得H2在常温下的体积;
(3)所得溶液中NaOH的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com