
����Ŀ��ʵ������һƿδ֪Ũ�ȵ�Na2S2O3��ͨ������ʵ��ⶨ��Ũ��
��ȡ10.0 mL Na2S2O3����ƿ�У�����ָʾ��2��3�Ρ�
��ȡһ�ζ���,���β�©��ϴ�ӣ���0.01 mol��L��1��I2��Һ��ϴ��Ȼ��ע��ñ���Һ,����Һ�棬���¶�����
������ƿ���ڵζ����½��еζ��������ķ�ӦΪ��I2+2Na2S2O3 =2NaI+Na2S4O6��
�Իش��������⣺
��1�������������ָʾ����__________��
��2���������ﵽ�ζ��յ���ж�__________________________________��
��3����֪���ı�Һʵ���������±���
ʵ����� | ʼ����(ml) | ĩ����(ml) |
1 | 0.10 | 19.20 |
2 | 1.85 | 20.75 |
3 | 0.00 | 24.06 |
���ˮ�е�Na2S2O3���ʵ���Ũ��Ϊ_______________��
��4�� ���в����ᵼ�²ⶨ���ƫ�ߵ���_________��
A���ζ�����װҺǰδ�ñ���Һ��ϴ
B���ζ������У���ƿ��̫���ң���ƿ����Һ�ν���
C��װ����Һ�ĵζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ��յ�ʱ��������
D���ﵽ�ζ��յ�ʱ�����Ӷ���
���𰸡�������Һ �������һ�α�Һʱ,��Һ����ɫ�����ɫ,��������ڲ���ɫ 0.038molL��1 AD
��������
��1�����ζ�ʵ��Ϊ����I2+2Na2S2O3=2NaI+2Na2S4O6�ⶨ����I2�Ӷ�ȷ��ˮ���е�Cl2��������ָʾ������ָʾ��Һ��I2��������Ӧ�õ�����Һ��ָʾ�����������������������������Һ��
��2���������۱������жϴﵽ�ζ��յ��ʵ�����������������һ�α�Һ����Һ����ɫ�����ɫ�Ұ�����ڲ��ָ�����������������������������һ�α�Һʱ����Һ����ɫ�����ɫ����������ڲ���ɫ��
��3����ͼ�������ݿ�֪�����ı�Һ�����������������19.10 mL��18.90 mL��24.06��24.06���̫������ȥ��������ı�Һ�����ƽ��Ϊ19.00 mL�����ݷ�ӦI2+2Na2S2O3 =2NaI+Na2S4O6��֪�����ˮ�е�Na2S2O3���ʵ���Ũ��Ϊ(19��0.01��2)/10=0.038molL��1������������������ǣ�0.038molL��1��
��4������![]() ��������
��������
A����ʽ�ζ���δ�ñ�������Һ��ϴ�ᵼ��c��������С����V������ƫ����������NaOH��ҺŨ��ƫ������ȷ��
B���ζ������У���ƿ��̫���ң���ƿ����Һ�ν��������´�����Һ������������С�����ı�Һ�����ƫС������NaOH��ҺŨ��ƫС������
C���ζ�ǰ�ζ��ܼ�����û�����ݣ��ζ��յ�ʱ�������ݣ���������ռ�пռ䣬��ᵼ��V���������ƫС���ʻᵼ������Ũ��ƫС��������
D���ﵽ�ζ��յ�ʱ�����Ӷ���������V���������ƫ�ᵼ������Ũ��ƫ������ȷ��
��������������ѡAD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С���о���������������ʱ���ı�ijһ�����Է�Ӧ[����aA��g��+bB��g��![]() cC��g����ʾ]��ѧƽ���Ӱ�죬�õ���ͼ��ͼ��p��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ���������ʾƽ��ת���ʣ���
cC��g����ʾ]��ѧƽ���Ӱ�죬�õ���ͼ��ͼ��p��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ���������ʾƽ��ת���ʣ���

����ͼ�ش��������⣺
��1����ͼ��Ӧ���У�������ӦΪ________������ȡ����ȡ�����Ӧ����p1��p2����˷�Ӧ�ġ�S________0����������������ɴ��жϣ����淴Ӧ�Է����У����������������____________��
��2����ͼ��Ӧ���У�T1_____T2���������������=������������ӦΪ_______������ȡ����ȡ�����Ӧ��
��3����ͼ��Ӧ���У���T1��T2����÷�Ӧ_______����ܡ����ܡ����Է����У�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ���������BaCl2��NaCl��Na2CO3�������ʵ��Լ���
A.AgNO3��ҺB.ϡ����C.ϡ����D.ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������е����仯�����Ӧ�úʹ���������㷺��ע��
��1���ϳɰ��ķ�Ӧԭ��ΪN2(g)+3H2(g)![]() 2NH3(g) ��H = -92.4 kJ/mol������ͼ��ʾ����6 mol N2��14 mol H2����һ�ݻ��ɱ���ܱ������з�����Ӧ����Ӧ��ʼʱ������λ����ͼ1��ʾ������Ӧ�ﵽƽ��ʱ������λ����ͼ2��ʾ�����б����������ж�ͼ2��ʾ״̬�Ѵ�ƽ�����________����������·�Ӧ��ƽ�ⳣ��Ϊ________��
2NH3(g) ��H = -92.4 kJ/mol������ͼ��ʾ����6 mol N2��14 mol H2����һ�ݻ��ɱ���ܱ������з�����Ӧ����Ӧ��ʼʱ������λ����ͼ1��ʾ������Ӧ�ﵽƽ��ʱ������λ����ͼ2��ʾ�����б����������ж�ͼ2��ʾ״̬�Ѵ�ƽ�����________����������·�Ӧ��ƽ�ⳣ��Ϊ________��

A�����������ƶ� B������������ѹǿ���ٸı�
C�������������ܶȲ��ٸı� D�������������ƽ�������������ٸı�
��2���о���ͨ��̽�����������÷���ȼ�ϵ�ؿ������º͵������½����ˮ�����뵪���ⷴӦ�ư��ϲ��������������Ļ�������Ϊ�м����ֱ�ӻ�ԭ���������乤��ԭ��ʾ��ͼ���£�д�������缫����ʽ________��
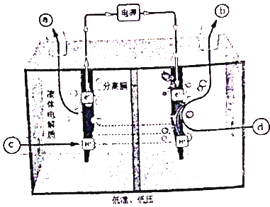
��3��SCR���ǹ�ҵ��������������ij��÷�������Ӧԭ��Ϊ��4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g)��
4N2(g)+6H2O(g)��
����֪4NH3(g)+ 3O2(g)![]() 2N2(g)+6H2O(g) ��H1 = -1269.0 kJ/mol��
2N2(g)+6H2O(g) ��H1 = -1269.0 kJ/mol��
N2(g)+ O2(g)![]() 2NO(g) ��H2 = +180.8 kJ/mol
2NO(g) ��H2 = +180.8 kJ/mol
��Ӧ4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g)����H = ________��
4N2(g)+6H2O(g)����H = ________��
�ڽ�һ��������O2��NH3��NOx�Ļ�����壬����ͨ��װ�д���M�ķ�Ӧ�����з�Ӧ10ʱ���NOx��ȥ�����淴Ӧ�¶ȵı仯��������ͼ��ʾ������͵���Ӧ�¶ȸ���380��ʱNOx��ȥ�������¶�������Ѹ���½������½���ԭ��________��
��������ͼ�л�����Ӧ8minʱNOx��ȥ�������¶ȱ仯�����ߡ�___
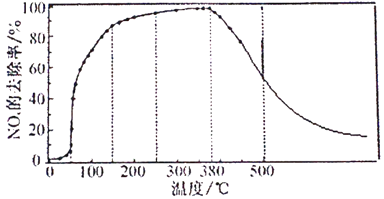
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A�ɷ�����ͼ����ʾ�ķ�Ӧ��
д����Ӧ���ʵĻ�ѧʽ�����(���ڱ�����)��������д��������Ӧ�Ļ�ѧ����ʽ��
A | B | C | D | E | |
��ѧʽ | Cu | CuCl2 | ____ | ____ | ____ |
�� �� | _____ | _____ | �� | ������ | �� |

(1)______________________________��
(2)______________________________��
(3)______________________________��
(4)______________________________��
(5)______________________________��
(6)______________________________ ��
(7)______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Һ����Ҫ�����������ӣ����жϸ���Һ�����ʲ�д������뷽��ʽ��
(1)H����CH3COO-_____________��_____________________��
(2)Fe3����SO42-_____________��_______________________��
(3)Na����HCO3-_____________��_______________________��
(4)H+��HS-��S2-_____________��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ���ȡCu2O�ĵ���ʾ��ͼ���ң�����ܷ�ӦΪ��2Cu��H2O![]() Cu2O��H2��������˵����ȷ����
Cu2O��H2��������˵����ȷ����

A. ʯī�缫�ϲ�������
B. ͭ�缫������ԭ��Ӧ
C. ͭ�缫��ֱ����Դ�ĸ���
D. ����0.1 mol����ת��ʱ����0.1 mol Cu2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����Ͻ���һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ�ġ���Ҫ�������£�

(1)Ϊ��ʹMgSO4ת��ΪMg(OH)2���Լ�������ѡ��________��ҪʹMgSO4��ȫת��Ϊ�����������Լ�����ӦΪ________________��
(2)�����Լ������ܹ�����õ�Mg(OH)2�����ķ�����_____________��
(3)�Լ���ѡ��________��д���䷴Ӧ�����ӷ���ʽ_______��
(4)��ˮMgCl2������״̬�£�ͨ������þ���������÷�Ӧ�Ļ�ѧ����ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѿ���Ϊ���ֳ��з�չ���ϰ��������γɵ�����Ҫԭ������Ϊ�ŷţ���������β����Ⱦ�������ġ����ס��������ӡ��ش��������⣺
(1)����β���к���NO��N2��O2����NO�Ĺ������£�

��1 mol O2��1 mol N2����������2 mol NO��������________(��ߡ��͡�)��
��![]() N2(g)��
N2(g)��![]() O2(g)===NO(g)�Ħ�H��________��
O2(g)===NO(g)�Ħ�H��________��
��NO��CO��Ӧ���Ȼ�ѧ����ʽ���Ա�ʾΪ2NO(g)��2CO(g)![]() 2CO2(g)��N2(g)����H��a kJ��mol��1�����÷�Ӧ���ʺ�������ʹ�û�����β����ת����������ʹβ���е�NO��COת�����������ų���������Ӧ��ʹ�á���ת��������aֵ________(ѡ�������С�����䡱)��
2CO2(g)��N2(g)����H��a kJ��mol��1�����÷�Ӧ���ʺ�������ʹ�û�����β����ת����������ʹβ���е�NO��COת�����������ų���������Ӧ��ʹ�á���ת��������aֵ________(ѡ�������С�����䡱)��
(2)����Դ����ɫȼ�ϣ����Լ�������β�����ŷţ����ü״���ˮ������Ӧ�����Ʊ�������CH3OH(g)��H2O(g)===CO2(g)��3H2(g)����H1����ͼ�Ǹ÷�Ӧ�������仯ͼ��

��ͨ��ͼ����Ϣ���жϷ�ӦCH3OH(g)��H2O(g)===CO2(g)��3H2(g)�Ħ�H1________(ѡ�>����������<��)0��
��ͼ��;��(��)��������_______________��;��(��)�ķ�Ӧ��________(ѡ�>����������<��);��(��)�ķ�Ӧ�ȡ�
����֪���������Ȼ�ѧ����ʽ��
H2(g)��![]() O2(g)===H2O(g)����H2
O2(g)===H2O(g)����H2
2CH3OH(g)��3O2(g)===2CO2(g)��4H2O(g)����H3
��H1����H2����H3���ߵĹ�ϵʽΪ��____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com