
【题目】下列物质中,既含有离子键又含有极性共价键的是( )
A.Ca(OH)2B.Na2OC.MgCl2D.H2O2
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列化学反应在金属冶炼工业中还没有得到应用的是( )
A. 2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
B. 2Ag2O![]() 4Ag+O2↑
4Ag+O2↑
C. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D. Al2O3+3C![]() 2Al+3CO↑
2Al+3CO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治环境污染,改善生态环境已成为全球的共识。
(1)向煤中加入石灰石作为脱硫剂,可以减少燃烧产物SO2的排放,生成CaSO4。写出SO2减少的化学方程式:___________________________________________。
(2)煤的气化和液化是高效、清洁利用煤炭的重要途径。将焦炭在高温下与水蒸气反应,得到CO和H2,发生该反应的化学方程式为:_______________________________。
(3)在汽车尾气系统中装置催化转化器,可有效降低尾气中的CO、NO、NO2和碳氢化合物等污染性气体。在催化转换器的前半部,CO和NO在催化剂的作用下发生反应,生成CO2和N2,该反应的化学方程式为:___________________________________。
(4)天然水中杂质较多,常需加入明矾、漂白粉等物质处理后才能饮用。其中漂白粉的作用是杀菌消毒,其作用原理可用化学方程式表示为:_________________________。
(5)处理含Cr2O72-的废水可先用(NH4)2Fe(SO4)2将Cr2O72-转化为Cr3+,再用氨水将Cr3+转变为难溶的Cr(OH)3,在该过程中氧化剂为______________,其中氨水转化Cr3+为Cr(OH)3的离子方程式为____________________________________________;该方案处理后的废水中因含有大量________元素,直接排放会导致水体富营养化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl固体,但现在只有混有Na2SO4、NH4HCO3的NaCl固体混合物。某学生设计了如图所示方案提取纯净的NaCl固体。(已知:NH4HCO3![]() NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)

如果此方案正确,回答下列问题:
(1)操作①可选择的主要仪器是(________)(多选题)
A.酒精灯 B. 蒸馏烧瓶 C. 坩埚
(2)操作②不用硝酸钡溶液,其理由是______________________________________。
(3)进行操作②后,如何判断SO42 已除尽,方法是________________________。
(4)操作③加的是(________)
A.Na2CO3溶液 B.K2CO3溶液 C. NaNO3溶液
(5)操作④的目的是(________)(多选题)
A.除去过量的BaCl2溶液
B.除去溶解在溶液中的CO2
C. 除去溶解在溶液中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①溶液都是纯净物 ②含氧的化合物都是氧化物 ③能电离出H+的化合物都是酸 ④能电离出OH-的化合物都是碱 ⑤能电离出金属离子和酸根离子的化合物都是盐 ⑥酸和碱的中和反应都是复分解反应
A.全部
B.⑤⑥
C.③④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
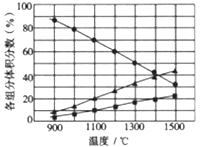
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。(已知:25℃时,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对pH值相同的盐酸和醋酸两种溶液的说法正确的是
A. 中和碱的能力相同 B. 盐酸和醋酸的物质的量浓度相同
C. OH-的物质的量浓度相同 D. H+的物质的量浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期主族元素,X、Y之间可形成Q、M两种常见的无机化合物,其中Q是重要的能源物质,W原子的最外层电子数是Z原子最外层电子数的2倍,W的单质广泛用于光伏发电,下列说法中正确的是
A. 常见氢化物的稳定性:X<W
B. 原子半径:W>Z>X>Y
C. 工业上用Q还原Z的氧化物得到Z单质
D. Z的单质能在M中剧烈燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知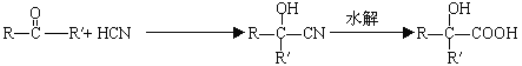 。分析下图变化,试回答下列问题:(E没有支链)
。分析下图变化,试回答下列问题:(E没有支链)

(1)写出下列有机物的结构简式:
A___________________C _______________________E ____________________F_________________。
(2)写出下列有关反应的化学方程式:
C →D_______________________;
D →E_______________________;
E→F_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com