
【题目】下列化学反应在金属冶炼工业中还没有得到应用的是( )
A. 2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
B. 2Ag2O![]() 4Ag+O2↑
4Ag+O2↑
C. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D. Al2O3+3C![]() 2Al+3CO↑
2Al+3CO↑
科目:高中化学 来源: 题型:
【题目】Ⅰ、前20号元素A、B、C、D,其中A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)C在周期表中的位置__________________________;
(2)B 元素的原子结构示意图____________________________;
(3)化合物D2C的电子式______________________________;
(4)B最简单气态氢化物与最简单的有机物的稳定性强弱关系(用相应的化学式表示):____ > ____;
(5)C、D离子的半径大小关系为C______D (填:>、=、<);
(6)B的氢化物与B的最高价氧化物对应水化物反应的生成物中含有的的化学键有__________填选项)。
A、只含离子键 B、既有离子键又有共价健
C、只含有共价键 D、既有极性共价键又有非极性共价键
Ⅱ、利用下图装置来验证同主族元素非金属性的变化规律:

(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C中溶液现象是:___________,即可证明。干燥管D的作用是___________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_________________溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中______________的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,因此应在B、D之间增加一个盛有足量__________的洗气装置(选填下列字母)
A.浓盐酸 B.浓NaOH溶液 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下6个反应(反应条件略):
A.2Na+2H2O ═2NaOH+H2↑ B.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
C.KClO3![]() 2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
E.Na2O+CO2 ═Na2CO3 F.CO2+C![]() 2CO
2CO
既属于化合反应又属于氧化还原反应的有__________(填编号,下同),不属于氧化还原反应的有__________.
(2)根据反应:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Fe3++2Br-,③ Br2+2I-===I2+2Br-,回答下列问题。
①试判断离子的还原性由强到弱的顺序是________
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
②某溶液中含有Br-、Fe2+、I-,为了氧化I-而不影响Br-和Fe2+,选用的氧化剂是__________;
③I2与Br-能否发生反应________
A.能 B.不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应KMn04+ HCl—KC1+ MnCl2+Cl2+ H20(未配平),若有0.1 mol KMn04参加反应,下列说法正确的是 ( )
A. 转移0.5 mol电子 B. 生成0.5 mol Cl2
C. 参加反应的HC1为1.6 mol D. Cl2是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0. 10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f=![]() ]与混合液pH的关系如图所示。下列说法正确的是
]与混合液pH的关系如图所示。下列说法正确的是
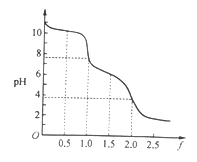
A. f=0时,溶液中:c(Na+)=2c(CO32-)
B. f=0.5时,溶液中:c(HCO3-)>c(CO32-)
C. f= 1时,溶液中:c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-)+c(OH-)
D. f=2时,溶液中:1/2c(Na+)=c(CO32-)+c( HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为 Fe2O3 和 Fe3O4)制备 PFS,其工艺流程如下图所示。
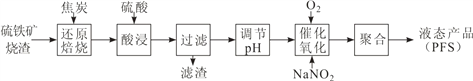
(1)CO是“还原焙烧”过程的主要还原剂。下图中,曲线表示 4 个化学反应 a、b、c、d 达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是 Fe2O3、Fe3O4、FeO、Fe 稳定存在的区域。a属于__________(填“吸热反应”或“放热反应”);570℃时,d 反应的平衡常数 K=___________________。
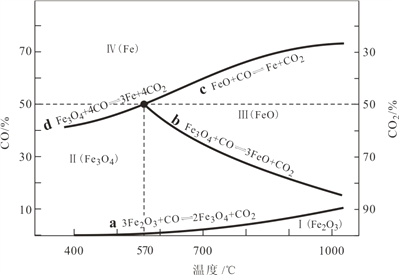
(2)800℃,混合气体中CO2的体积分数为40%时,Fe2O3用CO还原焙烧过程中发生的主要的化学反应方程式:________________________________________________
(3)若“酸浸”时间过长,浸出液 Fe2+含量反而降低,主要原因是___________________。
(4)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17,Ksp[Fe(OH)3]=1.0×10-39。若浸出液中c(Fe3+) = 10-1.8mol·L-1,为避免“催化氧化”过程中产生副产物 Fe(OH)3,应调节浸出液的 pH≤___________。
(5)FeSO4 溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4 ,该反应的离子方程式_____________________________________.
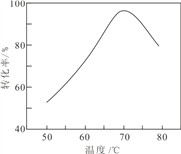
(6)“催化氧化”过程中,用 NaNO2 作催化剂(NO 起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+ 转化率随温度的升高先上升后下降的原因是___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是( )
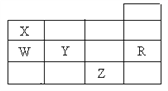
A. 通常情况下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的电负性比X的的电负性大
D. 第一电离能:R>W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A.在熔融状态下和溶解于水时均不导电的化合物,叫做非电解质
B.电解质、非电解质都对化合物而言,单质不在此范畴
C.在水中的电解质一定都导电性很强
D.水是极弱的电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com