
【题目】(1)有以下6个反应(反应条件略):
A.2Na+2H2O ═2NaOH+H2↑ B.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
C.KClO3![]() 2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
E.Na2O+CO2 ═Na2CO3 F.CO2+C![]() 2CO
2CO
既属于化合反应又属于氧化还原反应的有__________(填编号,下同),不属于氧化还原反应的有__________.
(2)根据反应:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Fe3++2Br-,③ Br2+2I-===I2+2Br-,回答下列问题。
①试判断离子的还原性由强到弱的顺序是________
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
②某溶液中含有Br-、Fe2+、I-,为了氧化I-而不影响Br-和Fe2+,选用的氧化剂是__________;
③I2与Br-能否发生反应________
A.能 B.不能
【答案】 F D、E B Fe3+ B
【解析】(1)有元素化合价升降的反应是氧化还原反应,因此既属于化合反应又属于氧化还原反应的是碳与二氧化碳反应生成CO,答案选F;A中Na和H元素的化合价变化,B中C与O元素的化合价变化,C中Cl与O元素的化合价变化,F中碳元素的化合价变化,它们均是氧化还原反应,因此不属于氧化还原反应的是D与E;(2)①氧化还原反应中还原剂的还原性强于还原产物的还原性,根据反应①可知还原性是I->Fe2+;根据反应②可知还原性是Fe2+>Br-;根据反应③可知还原性是I->Br-,所以离子的还原性由强到弱的顺序是I->Fe2+>Br-,答案选B。②根据还原性强弱顺序可知为了氧化I-而不影响Br-和Fe2+,选用的氧化剂是Fe3+;③碘离子的还原性强于溴离子,则I2与Br-不能发生反应,答案选B。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体。工艺原理如下图所示。下列说法中不正确的是( )
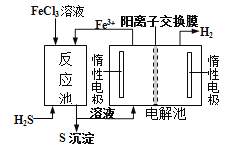
A. H+从电解池左槽迁移到右槽 B. 左槽中发生的反应是:2Cl--2e-=Cl2↑
C. 右槽的反应式: 2H++2e-=H2↑ D. FeCl3溶液可以循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物B是一种红棕色粉末,单质A和单质D是生活中常见的两种金属。它们在一定条件下按下图所示发生转化:

请回答:
(1)上述反应①②③④中属于氧化还原反应的是______________(填写序号)。
(2)写出下列物质化学式:B______,E______,F___________;
(3)将足量的CO2通入E溶液中,离子方程式是_____________________。
(4)H在空气中很容易被氧化成I,该过程的现象是___________________,该反应过程的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《神农本草经》记载,神农尝百草,日遇七十二毒,得茶而解。茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
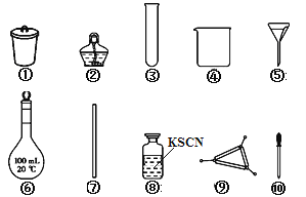
A. 将茶叶灼烧灰化,选用①、②和⑨
B. 用浓盐酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C. 过滤得到滤液,选用④、⑤和⑦
D. 检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
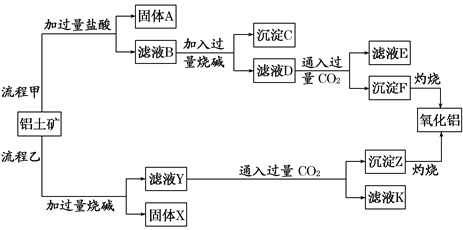
(1)写出流程甲加入盐酸后生成Al3+的离子方程式:___________________________。
(2)写出流程乙加入烧碱后生成SiO![]() 的离子方程式:___________________________。
的离子方程式:___________________________。
(3)为了验证滤液B中含Fe3+,可取少量滤液并加入___________(填试剂名称)。
(4)滤液E 、K中溶质的主要成分是_____(填化学式),写出该溶液的一种用途:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100 g质量分数为46%的乙醇(C2H6O)水溶液中含有的氧原子数为4NA
B. 2 mol Cu与100 mL浓度为18.4 mol·L1的浓硫酸在加热条件下充分反应,生成SO2分子数为0.92NA
C. 0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
D. 0.1 mol/L的Ba(OH)2溶液中,OH的个数为0.2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:________________________________。
铁锈的主要成分是____________(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:_____________________。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
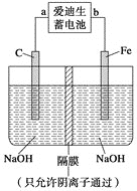
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是__________。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式__________________________。
③你认为高铁酸钠作为一种新型净水剂的理由可能是______。
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-浓度最大的 ( )
A.200mL 2mol/L MgCl2溶液B.1000mL 2.5mol/L NaCl溶液
C.250mL 1mol/L AlCl3溶液D.200mL 4.5mol/L KClO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com