
【题目】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
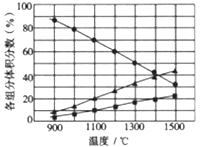
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。(已知:25℃时,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。
【答案】 1076 0.044 不变 增大 反应ⅰ为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应ⅱ为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大 2H2S![]() 2H2+S2 0.02mol·L1·min1 4.0×1014mol·L1
2H2+S2 0.02mol·L1·min1 4.0×1014mol·L1
【解析】Ⅰ.试题分析:H2S是煤化工原料气脱硫过程的重要中间体,反应原理为ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol-1,该反应为吸热反应 ;ⅱ.CO(g)+H2O(g)
H2S(g)+CO(g)△H=+7kJ·mol-1,该反应为吸热反应 ;ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-42kJ·mol-1,该反应为放热反应。
CO2(g)+H2(g)△H=-42kJ·mol-1,该反应为放热反应。
(1)化学反应的反应热等于反应物的键能总和减去生成物的键能总和。由COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ·mol-1可知,1310+442-x-669=7,所以x=1076。
H2S(g)+CO(g) △H=+7kJ·mol-1可知,1310+442-x-669=7,所以x=1076。
(2)T℃时,向VL容积不变的密闭容器中充入1molCOS(g)、1molH2(g)和1molH2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80mol,H2为0.85mol,由物料守恒可以求出H2S和CO 的平衡量分别为0.20mol和0.15mol,由于反应ⅰ中各组分的化学计量数均为1,所以,T℃时反应ⅰ的平衡常数K=![]() 。
。
②上述反应达平衡后,若向其中再充入1molCOS(g)、1molH2(g)和1molH2O(g),则与原平衡体系的起始投料的配比相同,由于两个反应均分气体分子数不变的反应,所以再次达平衡后H2的体积分数不变;若升高温度,则CO的平衡体积分数增大,因为反应ⅰ为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;而反应ⅱ为放热反应,升高温度,平衡逆向移动也使CO的平衡体积分数也增大。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,由图中数据可知,混合气体中两种生成物的体积分数不同,其中一种生成物的体积分数约是另一种的2倍,由此可以推断,H2S主要分解为H2和S2,则在此温度区间内,H2S分解反应的主要化学方程式为2H2S![]() 2H2+S2;在1300℃时,反应经2min达到平衡,由图中数据可知,此时的体积分数为50%,设H2S的变化量为x,则H2和S2的变化量分别为x和0.5x,则
2H2+S2;在1300℃时,反应经2min达到平衡,由图中数据可知,此时的体积分数为50%,设H2S的变化量为x,则H2和S2的变化量分别为x和0.5x,则![]() ,解之得x=0.08mol,所以,0~2min的反应速率v(H2S)=
,解之得x=0.08mol,所以,0~2min的反应速率v(H2S)= ![]() 0.02mol·L-1·min-1。
0.02mol·L-1·min-1。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L-1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,c(S2-)![]() mol/L,所以,溶液中c(Ag+)=
mol/L,所以,溶液中c(Ag+)=![]() 4.0×10-14mol·L-1。
4.0×10-14mol·L-1。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
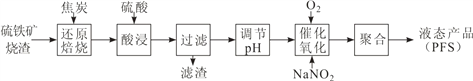
【题目】聚合硫酸铁(PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为 Fe2O3 和 Fe3O4)制备 PFS,其工艺流程如下图所示。
(1)CO是“还原焙烧”过程的主要还原剂。下图中,曲线表示 4 个化学反应 a、b、c、d 达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是 Fe2O3、Fe3O4、FeO、Fe 稳定存在的区域。a属于__________(填“吸热反应”或“放热反应”);570℃时,d 反应的平衡常数 K=___________________。
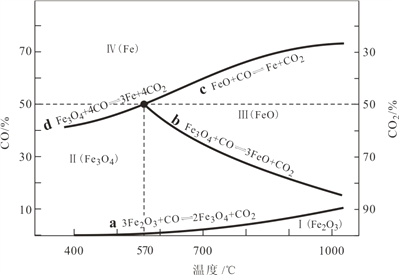
(2)800℃,混合气体中CO2的体积分数为40%时,Fe2O3用CO还原焙烧过程中发生的主要的化学反应方程式:________________________________________________
(3)若“酸浸”时间过长,浸出液 Fe2+含量反而降低,主要原因是___________________。
(4)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17,Ksp[Fe(OH)3]=1.0×10-39。若浸出液中c(Fe3+) = 10-1.8mol·L-1,为避免“催化氧化”过程中产生副产物 Fe(OH)3,应调节浸出液的 pH≤___________。
(5)FeSO4 溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4 ,该反应的离子方程式_____________________________________.
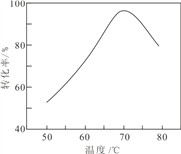
(6)“催化氧化”过程中,用 NaNO2 作催化剂(NO 起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+ 转化率随温度的升高先上升后下降的原因是___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
![]() (浓)
(浓)![]()
![]()
试完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______(用字母代号填写)
a.酸 b. 碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)该反应中被氧化的元素是_________________,参加反应的氧化剂与还原剂的物质的量之比为______。
(3)写出该反应的化学方程式并用双线桥标出电子转移的方向和数目:____________。
(4)一定量的铜片与100mL 18 mol/L的浓![]() 充分反应,如果该反应过程中转移了0.2mol电子,生成的
充分反应,如果该反应过程中转移了0.2mol电子,生成的![]() 的质量为_________g,生成的A气体在标准状况下体积为________L(假设气体全部逸出)。
的质量为_________g,生成的A气体在标准状况下体积为________L(假设气体全部逸出)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1H3AsO3溶液中逐滴加入KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。下列说法正确的是( )
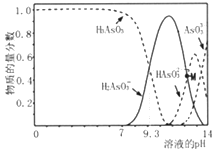
A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的说法中,正确的是( )
A.任何化学反应上都能设计成原电池
B.原电池工作时,阳离子向负极移动
C.原电池的负极发生氧化反应
D.原电池工作时,电子通过电解质溶液流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液是中学化学的重点研究对象
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol·L-1,则该电解质可能是______(填序号)。
A. CuSO4 B. HCl C. Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HC1O)增大,可以采取的措施为(至少回答两种)________________________________________。
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×10-3mol.L-1的氨水b L;②c(OH -)=1.0×10-3mol·L-l的氨水cL;③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液d L。则a、b、c、d之间的关系是___________________________________。
(4)强酸制弱酸是水溶液中的重要经验规律。
已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为_______________________。
(5)已知:H2A═H++HA-、HA-![]() H++A2-,常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是:____________;NaHA溶液中各种离子浓度大小关系为_______________________。
H++A2-,常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是:____________;NaHA溶液中各种离子浓度大小关系为_______________________。
(6)己知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mo1`L-l的AgNO3溶液中加入相同体积0.020mol`L-1的盐酸,则c(Ag+)=____________,此时所得混合溶液的pH=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氯酸钾和二氧化锰制取氧气的反应方程式为:2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
回答下列问题:
(1)该反应中被氧化的元素名称为______,生成1mol![]() 时转移电子的数目是______。
时转移电子的数目是______。
(2)从反应后的固体混合物中分离出难溶于水的![]() 的具体实验操作步骤:______。
的具体实验操作步骤:______。
(3)分离出的![]() 可用于实验室制取
可用于实验室制取![]() ,化学方程式为:MnO2+4HCl(浓)
,化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其离子方程式为____。
MnCl2+Cl2↑+2H2O,其离子方程式为____。
(4)若两个反应中转移的电子的物质的量相同,则生成的![]() 和
和![]() 在相同状况下的体积比为____。
在相同状况下的体积比为____。
(5)以上两个反应都用到![]() ,其作用分别是 ______、_________。
,其作用分别是 ______、_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com