
【题目】水溶液是中学化学的重点研究对象
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol·L-1,则该电解质可能是______(填序号)。
A. CuSO4 B. HCl C. Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HC1O)增大,可以采取的措施为(至少回答两种)________________________________________。
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×10-3mol.L-1的氨水b L;②c(OH -)=1.0×10-3mol·L-l的氨水cL;③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液d L。则a、b、c、d之间的关系是___________________________________。
(4)强酸制弱酸是水溶液中的重要经验规律。
已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为_______________________。
(5)已知:H2A═H++HA-、HA-![]() H++A2-,常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是:____________;NaHA溶液中各种离子浓度大小关系为_______________________。
H++A2-,常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是:____________;NaHA溶液中各种离子浓度大小关系为_______________________。
(6)己知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mo1`L-l的AgNO3溶液中加入相同体积0.020mol`L-1的盐酸,则c(Ag+)=____________,此时所得混合溶液的pH=__________。
【答案】 CD 再通入氯气、加入碳酸钙、加入次氯酸钠等 b>a=d>c A->B2->HB- 0.1mol/L+)<0.11mol/L c( Na+)>c(HA-)>c( H+)>c( A2-)>c(OH-) 1.8×10-7mol/L 2
【解析】(1)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol·L-1,则该溶液显碱性,电解质可能是碱,也可能是水解显碱性的盐,故选CD。。
(2)氯水中存在化学平衡Cl2+H2OHCl+HClO,要使新制稀氯水中的c(HC1O)增大,应设法让化学平衡向正反应方向移动,可以采取的措施为再通入氯气(增大氯气的浓度)、加入碳酸钙(与盐酸反应减小生成物浓度);或者加入次氯酸钠抑制次氯酸电离,也可以增大c(HC1O)。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。①因为盐酸和氨水反应后生的氯化铵水解显酸性,故加入浓度为1.0×10-3molL-1的氨水bL使溶液显中性时,氨水过量,所以b>a;②c(OH-)=1.0×10-3mol·L-l的氨水,其物质的量浓度远远大于1.0×10-3molL-1的氨水,故a>c;③氢氧化钡溶液中c(OH-)=1.0×10-3mol·L-1与pH=3的盐酸中c(H+)相同,故a=d。综上所述,a、b、c、d之间的关系是b>a=d>c。
(4)已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,此反应的发生,证明酸性(即电离出H+的能力)H2B>HB->HA,所以A-、B2-、HB-三种阴离子结合H+的难易顺序为A->B2->HB-。
(5)已知H2A═H++HA-、HA-![]() H++A2-,由此可知H2A是强酸,其一级电离是完全电离的,其二级电离是不完全的。常温下,0.1mol·L-1的NaHA溶液其pH=2,则此溶液中c( H+)=0.01mol/L,故在此条件下HA-的电离度为10%。0.1mol·L-1的H2A溶液中,由于其一级电离产生的H+对其二级电离产物抑制作用,故在此溶液中,HA-的电离度小于10%,因此,氢离子浓度的大小范围是0.1mol/L<c( H+)<0.11mol/L;NaHA溶液中各种离子浓度大小关系为c( Na+)>c(HA-)>c( H+)>c( A2-)>c(OH-)。
H++A2-,由此可知H2A是强酸,其一级电离是完全电离的,其二级电离是不完全的。常温下,0.1mol·L-1的NaHA溶液其pH=2,则此溶液中c( H+)=0.01mol/L,故在此条件下HA-的电离度为10%。0.1mol·L-1的H2A溶液中,由于其一级电离产生的H+对其二级电离产物抑制作用,故在此溶液中,HA-的电离度小于10%,因此,氢离子浓度的大小范围是0.1mol/L<c( H+)<0.11mol/L;NaHA溶液中各种离子浓度大小关系为c( Na+)>c(HA-)>c( H+)>c( A2-)>c(OH-)。
(6)己知: mol`L-1,向50mL0.018mo1`L-l的AgNO3溶液中加入相同体积0.020mol`L-1的盐酸,两者反应后,Cl-过量,,溶液中c(Cl-)=![]() mol/L=0.001mol/L,根据Ksp(AgCl)=1.8×10-10可以求出,c(Ag+)=
mol/L=0.001mol/L,根据Ksp(AgCl)=1.8×10-10可以求出,c(Ag+)=![]() 1.8×10-7mol/L,由于氢离子不参加离子反应,所以此时所得混合溶液中c(H+)=0.010mol/L,pH=2。
1.8×10-7mol/L,由于氢离子不参加离子反应,所以此时所得混合溶液中c(H+)=0.010mol/L,pH=2。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下图(忽略溶液体积的变化、H2S的挥发)。

①pH=11时,溶液中的c(H2S)+c(HS-)=________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(2)25 ℃,两种酸的电离常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HCO![]() 的电离常数表达式K=________。
的电离常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl固体,但现在只有混有Na2SO4、NH4HCO3的NaCl固体混合物。某学生设计了如图所示方案提取纯净的NaCl固体。(已知:NH4HCO3![]() NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)

如果此方案正确,回答下列问题:
(1)操作①可选择的主要仪器是(________)(多选题)
A.酒精灯 B. 蒸馏烧瓶 C. 坩埚
(2)操作②不用硝酸钡溶液,其理由是______________________________________。
(3)进行操作②后,如何判断SO42 已除尽,方法是________________________。
(4)操作③加的是(________)
A.Na2CO3溶液 B.K2CO3溶液 C. NaNO3溶液
(5)操作④的目的是(________)(多选题)
A.除去过量的BaCl2溶液
B.除去溶解在溶液中的CO2
C. 除去溶解在溶液中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
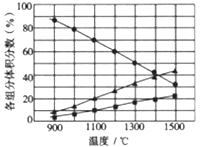
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。(已知:25℃时,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对pH值相同的盐酸和醋酸两种溶液的说法正确的是
A. 中和碱的能力相同 B. 盐酸和醋酸的物质的量浓度相同
C. OH-的物质的量浓度相同 D. H+的物质的量浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺卜醇可用于调制木香型化妆品及皂用香精。一种制备方法如图所示,下列说法正确的是
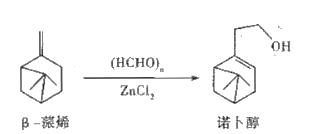
A. 可用溴的CCl4溶液区别β-蒎烯与诺卜醇
B. β-蒎烯的饱和碳原子上的一氯代物最多有7种
C. β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D. 可用乙酸检验β-蒎烯是否含有诺卜醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期主族元素,X、Y之间可形成Q、M两种常见的无机化合物,其中Q是重要的能源物质,W原子的最外层电子数是Z原子最外层电子数的2倍,W的单质广泛用于光伏发电,下列说法中正确的是
A. 常见氢化物的稳定性:X<W
B. 原子半径:W>Z>X>Y
C. 工业上用Q还原Z的氧化物得到Z单质
D. Z的单质能在M中剧烈燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯M,常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。M属于芳香族化合物,苯环上只含有一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162g·mol-1,只含碳、氢、氧,且原子个数之比为5:5:1。
(1)肉桂酸甲酯的结构简式是______________________。
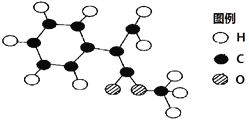
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。G的结构简式为_________________。
(3)用芳香烃A为原料合成G的路线如下:
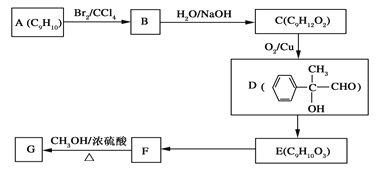
①化合物E中的官能团有________(填名称)。
②E→F的反应类型是________,
F→G的化学方程式为__________________________________________________。
③写出两种符合下列条件的F的稳定的同分异构体的结构简式_________________。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.在催化剂作用下,1mol该物质与足量氢气充分反应,最多消耗5mol H2;
ⅲ.它不能发生水解反应,但可以发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是__________________。
(2)实验室可以用铜和稀硝酸反应制取NO,反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑ +4H2O
①该反应中还原剂为__________
②氧化剂与还原剂之比是__________
③如果反应中转移了0.15mol电子,则产生的气体在标准状况下体积为______________
④用双线桥标出该反应转移电子数目情况_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com