
����Ŀ���о���Ԫ�ؼ��仯��������ʾ�����Ҫ���塣
(1)25 �棬��0.10 mol��L��1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c(S2��)��ϵ����ͼ(������Һ����ı仯��H2S�Ļӷ�)��

��pH��11ʱ����Һ�е�c(H2S)��c(HS��)��________mol��L��1��
��ij��Һ��0.020 mol��L��1Mn2����0.10 mol��L��1H2S������ҺpH��________ʱ��Mn2����ʼ������[��֪��Ksp(MnS)��2.8��10��13]
(2)25 �棬������ĵ��볣�����±���
Ka1 | Ka2 | |
H2SO3 | 1.3��10��2 | 6.3��10��8 |
H2CO3 | 4.2��10��7 | 5.6��10��11 |
��HCO![]() �ĵ��볣������ʽK��________��
�ĵ��볣������ʽK��________��
��0.10 mol��L��1Na2SO3��Һ������Ũ���ɴ�С��˳��Ϊ___________________��
��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ__________________________��
���𰸡� 0.087 5 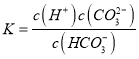 c(Na��)>c(SO
c(Na��)>c(SO![]() )>c(OH��)>c(HSO
)>c(OH��)>c(HSO![]() )>c(H��) H2SO3��HCO
)>c(H��) H2SO3��HCO![]() ===HSO
===HSO![]() ��H2O��CO2��
��H2O��CO2��
��������(1) �� ����SԪ�������غ���c(H2S)��c(HS��)+c(S2-)��0.1 mol��L��1 �� pH��11ʱ��c(S2-)=0.013mol/L������c(H2S)��c(HS��)=0.1mol/L-0.013mol/L=0.087mol/L���ڵ���Һ��Mn2+��Ũ����S2-Ũ�ȵ�Ũ����Qc> Ksp(MnS)ʱ��Mn2+��ʼ������������0.020��c(S 2-)>2.8��10��13��c(S2-)>1.4��10-11������ͼ���֪��ʱpH��5����pH��5ʱMn2+ ��ʼ������
(2) �ٸ��ݶ���д��HCO3-�ĵ��볣������ʽ: 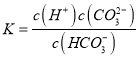 ����Na2SO3��Һ�У�Na+��Ũ�����SO32-������������ˮ�⣬��һ��ˮ����ڵڶ���ˮ�⣬����ˮ�������OH-������ˮ��õ���OH-��Ũ�ȴ���HSO3����Ũ�ȣ�H+Ũ����С����������Ũ���ɴ�С��˳��Ϊ��c(Na��)>c(SO32-)>c(OH��)>c(HSO3-)>c(H��)���۸���������ĵ��볣����֪H2SO3�����Դ���H2CO3�����ԣ�����H2SO3��NaHCO3��Ӧʱ�ܹ�����H2CO3�����ӷ���ʽΪ��H2SO3+HCO3-=HSO3-+CO2��+H2O��
����Na2SO3��Һ�У�Na+��Ũ�����SO32-������������ˮ�⣬��һ��ˮ����ڵڶ���ˮ�⣬����ˮ�������OH-������ˮ��õ���OH-��Ũ�ȴ���HSO3����Ũ�ȣ�H+Ũ����С����������Ũ���ɴ�С��˳��Ϊ��c(Na��)>c(SO32-)>c(OH��)>c(HSO3-)>c(H��)���۸���������ĵ��볣����֪H2SO3�����Դ���H2CO3�����ԣ�����H2SO3��NaHCO3��Ӧʱ�ܹ�����H2CO3�����ӷ���ʽΪ��H2SO3+HCO3-=HSO3-+CO2��+H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش�����������
(1)��̬Asԭ�ӵĺ�������Ų�ʽΪ[Ar]_________��Asԭ�ӵ�������(kJ/mol)����������
��һ������ | �ڶ������� | ���������� | ���ĵ����� | ��������� | ���������� |
947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
�����������������������������ԭ��:_____________________________________��
(2)�����Ǿ����۷��ӣ����ͽṹ����֤�������ǷǾ������ɿ�������__________��
A.���� B.ԭ�ӷ������ C.�˴Ź����� D.X��������
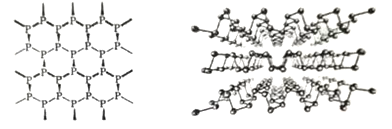
(3)���������Ͷ�ά�뵼����ϣ���������ʯīһ����Ƭ��ṹ(��ͼ)�������֮����_____��ϡ��ӽṹ�Ͽ���������ϩ����������ʯīϩ��ԭ����____________________________��
(4)����(P4)��������������ṹ��3.1g��������������ĿΪ________������(P4)�����ڶ���̼��������ˮ����ԭ����_____________________________________________��
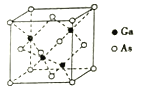
(5)GaAs���۵�Ϊ1238�棬�侧���ṹ��ͼ��ʾ���þ��������Ϊ_________��Gaԭ�ӵ��ӻ���ʽΪ______________��ÿ��Asԭ����Χ�����Asԭ����ĿΪ________����֪GaAs���ܶ�Ϊdg/cm3��Ħ������ΪMg/mol�����������As��Gaԭ�Ӻ˼��Ϊ_____(�����ӵ�����ֵ��NA��ʾ���г���ʽ����)nm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�ӦKMn04+ HCl��KC1+ MnCl2+Cl2+ H20��δ��ƽ��������0.1 mol KMn04�μӷ�Ӧ������˵����ȷ���� �� ��
A. ת��0.5 mol���� B. ����0.5 mol Cl2
C. �μӷ�Ӧ��HC1Ϊ1.6 mol D. Cl2�ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ���������PFS����һ�ָ�Ч�����߷�����������ij�������þ���ѡ����������������Ч�ɷ�Ϊ Fe2O3 �� Fe3O4���Ʊ� PFS���乤����������ͼ��ʾ��
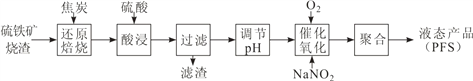
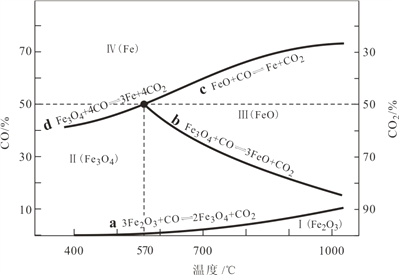
��1��CO�ǡ���ԭ���ա����̵���Ҫ��ԭ������ͼ�У����߱�ʾ 4 ����ѧ��Ӧ a��b��c��d �ﵽƽ��ʱ������ɺ��¶ȵĹ�ϵ�����ֱ��� Fe2O3��Fe3O4��FeO��Fe �ȶ����ڵ�����a����__________������ȷ�Ӧ�����ȷ�Ӧ������570��ʱ��d ��Ӧ��ƽ�ⳣ�� K=___________________��
��2��800�棬���������CO2���������Ϊ40��ʱ��Fe2O3��CO��ԭ���չ����з�������Ҫ�Ļ�ѧ��Ӧ����ʽ��________________________________________________
��3�����������ʱ�����������Һ Fe2+�����������ͣ���Ҫԭ����___________________��
��4����֪��25��ʱ��Ksp[Fe(OH)2]=1.0��10-17��Ksp[Fe(OH)3]=1.0��10-39��������Һ��c(Fe3+) = 10-1.8mol��L-1��Ϊ���⡰�������������в��������� Fe(OH)3��Ӧ���ڽ���Һ�� pH��___________��
��5��FeSO4 ��Һ�ڿ����лỺ�������������ܵ�Fe(OH)SO4 ���÷�Ӧ�����ӷ���ʽ_____________________________________.
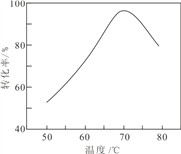
��6�����������������У��� NaNO2 ��������NO ��ʵ���ϵĴ����ã�ʱ���¶���Fe2+ת���ʵĹ�ϵ����ͼ��ʾ����Ӧʱ����ͬ����Fe2+ ת�������¶ȵ��������������½���ԭ����___________________________________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X�� Y��Z����Ԫ�ص������У���ȷ���ǣ� ��
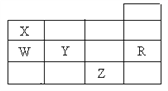
A. ͨ�����������Ԫ�صĵ����У�Z���ʵķе����
B. Y��Z�������ӵ��Ӳ�ṹ����Rԭ�ӵ���ͬ
C. W�ĵ縺�Ա�X�ĵĵ縺�Դ�
D. ��һ�����ܣ�R��W��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����������ɫ���壬������ˮ����һ����Ҫ�Ĺ�ҵԭ�ϣ��������Ʊ���Ѫ������������Ҳ�������ɳ���صĵ缫��ij�о�С��ͨ������ʵ�飬Ѱ�����ø��ֽⷴӦ�Ʊ� FeCO3 ��������ѷ�����
ʵ�� | �Լ� | ���� | |
�ι� | �Թ� | ||
| 0.8 mol/L FeSO4 ��Һ��pH=4.5�� | 1 mol/L Na2CO3 ��Һ ��pH=11.9�� | ʵ���������������ɫ������5min ��������Եĺ��ɫ |
0.8 mol/L FeSO4 ��Һ��pH=4.5�� | 1 mol/L NaHCO3 ��Һ ��pH=8.6�� | ʵ�������ɫ������������ɫ���ݣ�2min ��������ԵĻ���ɫ | |
0.8 mol/L (NH4)2Fe(SO4)2 ��Һ��pH=4.0�� | 1 mol/L NaHCO3 ��Һ ��pH=8.6�� | ʵ�������ɫ��������ɫ���ݣ��ϳ�ʱ�䱣�ְ�ɫ | |
(1)ʵ�� I �к��ɫ����������ԭ��������·�Ӧ��ʾ���벹ȫ��Ӧ��
��Fe2+ +��____+�� + ��H2O=�� Fe(OH)3 +��HCO3
(2)ʵ�� II �в��� FeCO3 �����ӷ���ʽΪ_____________________________��
(3)Ϊ��̽��ʵ�� III �� NH4+��������ã���ͬѧ�����ʵ�� IV ����̽����
���� | ���� | |
ʵ�� IV | �� 0.8 mol/L FeSO4 ��Һ�м����__________���ټ��� Na2SO4 �������Ƴɻ����Һ����֪ Na+��ʵ����Ӱ�죬���Ի�Ϻ���Һ����仯������ȡ����Һһ�ιܣ��� 2mL 1 mol/L NaHCO3 ��Һ��� | ��ʵ�� III ������ͬ |
ʵ�� IV �м��� Na2SO4 �����Ŀ���Ǣ�_______________________��
�Ա�ʵ�� II��III��IV����ͬѧ�ó����ۣ�NH4+ˮ����� H+��������Һ pH�������˸����� Fe(OH)2 �IJ�����
��ͬѧ��Ϊ��ʵ�鷽�������Ͻ���Ӧ����ĶԱ�ʵ������ǣ���_____________����ȡ����Һһ�ιܣ��� 2mL 1 mol/L NaHCO3 ��Һ��ϡ�
(4)С��ͬѧ��һ��������Ϊ������ʵ��������ֱ��֤��ʵ�� III �� FeCO3 �Ĵ�����ߣ���Ҫ������ͼ��ʾ��װ�ý��ж����ⶨ���ֱ�ʵ�� I��II��III �еij������й��ˡ�ϴ�ӡ�����������Ȼ��ת���� A ���Ĺ��ƿ�С�
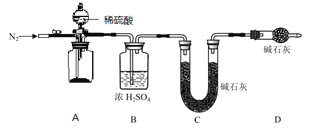
Ϊ�ⶨ FeCO3 �Ĵ��ȣ�����Ʒ�������⣬����ⶨ����������______________________��
(5)ʵ�鷴˼�����ⶨ��ʵ�� III �е� FeCO3 ���ȸ��ڷ��� I �ͷ��� II��ͨ������ʵ��������Ʊ� FeCO3 ʵ��ɹ��Ĺؼ�������_______________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���ȷ����( )
A.������״̬�º��ܽ���ˮʱ��������Ļ���������ǵ����
B.����ʡ��ǵ���ʶ��Ի�������ԣ����ʲ��ڴ˷���
C.��ˮ�еĵ����һ���������Ժ�ǿ
D.ˮ�Ǽ����ĵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͭ��Ũ��������ڼ��������·������·�Ӧ(��Ӧ����ʽ����ƽ)��
![]() (Ũ)
(Ũ)![]()
![]()
�������������⣺
(1)A���ʿ��Ե���������γɡ���AӦ������______(����ĸ������д)
a���� b�� �� c���� d������������ e������������
(2)�÷�Ӧ�б�������Ԫ����_________________���μӷ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ______��
(3)д���÷�Ӧ�Ļ�ѧ����ʽ����˫���ű������ת�Ƶķ������Ŀ��____________��
(4)һ������ͭƬ��100mL 18 mol/L��Ũ![]() ��ַ�Ӧ������÷�Ӧ������ת����0.2mol���ӣ����ɵ�
��ַ�Ӧ������÷�Ӧ������ת����0.2mol���ӣ����ɵ�![]() ������Ϊ_________g�����ɵ�A�����ڱ�״�������Ϊ________L(��������ȫ���ݳ�)��
������Ϊ_________g�����ɵ�A�����ڱ�״�������Ϊ________L(��������ȫ���ݳ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��Һ����ѧ��ѧ���ص��о�����
��1��ˮ�Ǽ����ĵ���ʣ�Ҳ������Ҫ���ܼ���������ij������ܽ���ˮ�к���Һ�е�c��H+��=10-9mol��L-1����õ���ʿ�����______������ţ���
A�� CuSO4 B�� HCl C�� Na2S D��NaOH E��K2SO4
��2����֪�������DZ�̼�ỹ�����ᣬҪʹ����ϡ��ˮ�е�c(HC1O)�����Բ�ȡ�Ĵ�ʩΪ�����ٻش����֣�________________________________________��
��3�������£���pH=3������a L�ֱ�������������Һ��ϣ������Һ�������ԡ�
��Ũ��Ϊ1.0��10-3mol��L-1�İ�ˮb L����c��OH -��=1.0��10-3mol��L-l�İ�ˮcL����c��OH-��=1.0��10-3mol��L-1������������Һd L����a��b��c��d֮��Ĺ�ϵ��___________________________________��
��4��ǿ����������ˮ��Һ�е���Ҫ������ɡ�
��֪HA��H2B���������ᣬ�������¹�ϵ��H2B��������+2A-=B2-+2HA����A-��B2-��HB-���������ӽ��H+������˳��Ϊ_______________________��
��5����֪��H2A�TH++HA-��HA-![]() H++A2-�������£�0.1mol��L-1��NaHA��Һ��pH=2����0.1mol��L-1��H2A��Һ��������Ũ�ȵĴ�С��Χ�ǣ�____________��NaHA��Һ�и�������Ũ�ȴ�С��ϵΪ_______________________��
H++A2-�������£�0.1mol��L-1��NaHA��Һ��pH=2����0.1mol��L-1��H2A��Һ��������Ũ�ȵĴ�С��Χ�ǣ�____________��NaHA��Һ�и�������Ũ�ȴ�С��ϵΪ_______________________��
��6����֪��Ksp��AgCl��=1.8��10-10����50mL 0.018mo1`L-l��AgNO3��Һ�м�����ͬ���0.020mol`L-1�����ᣬ��c��Ag+��=____________����ʱ���û����Һ��pH=__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com