
【题目】诺卜醇可用于调制木香型化妆品及皂用香精。一种制备方法如图所示,下列说法正确的是
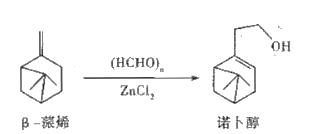
A. 可用溴的CCl4溶液区别β-蒎烯与诺卜醇
B. β-蒎烯的饱和碳原子上的一氯代物最多有7种
C. β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D. 可用乙酸检验β-蒎烯是否含有诺卜醇
【答案】C
【解析】A项,β-蒎烯和诺卜醇中都含有碳碳双键,都能使溴的CCl4溶液褪色,用溴的CCl4溶液不能区别β-蒎烯和诺卜醇,A项错误;B项,β-蒎烯的饱和碳原子上有6种H原子,β-蒎烯的饱和碳原子上的一氯代物最多有6种,B项错误;C项,β-蒎烯和诺卜醇中与两个-CH3直接相连碳原子为饱和碳原子,该碳原子与周围4个碳原子构成四面体,C项正确;D项,β-蒎烯中官能团为碳碳双键,诺卜醇中官能团为碳碳双键和醇羟基,虽然诺卜醇能与乙酸反应,但无明显实验现象,不能用乙酸检验β-蒎烯是否含有诺卜醇,检验β-蒎烯中是否含诺卜醇应用Na,加入Na若产生气泡则含诺卜醇,不产生气泡则不含诺卜醇,D项错误;答案选C。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
□Fe2+ +□____+□ + □H2O=□ Fe(OH)3 +□HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验 IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
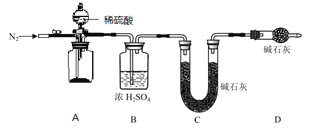
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1H3AsO3溶液中逐滴加入KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。下列说法正确的是( )
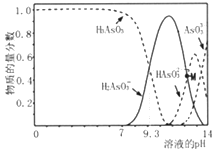
A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的说法中,正确的是( )
A.任何化学反应上都能设计成原电池
B.原电池工作时,阳离子向负极移动
C.原电池的负极发生氧化反应
D.原电池工作时,电子通过电解质溶液流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液是中学化学的重点研究对象
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol·L-1,则该电解质可能是______(填序号)。
A. CuSO4 B. HCl C. Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HC1O)增大,可以采取的措施为(至少回答两种)________________________________________。
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×10-3mol.L-1的氨水b L;②c(OH -)=1.0×10-3mol·L-l的氨水cL;③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液d L。则a、b、c、d之间的关系是___________________________________。
(4)强酸制弱酸是水溶液中的重要经验规律。
已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为_______________________。
(5)已知:H2A═H++HA-、HA-![]() H++A2-,常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是:____________;NaHA溶液中各种离子浓度大小关系为_______________________。
H++A2-,常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是:____________;NaHA溶液中各种离子浓度大小关系为_______________________。
(6)己知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mo1`L-l的AgNO3溶液中加入相同体积0.020mol`L-1的盐酸,则c(Ag+)=____________,此时所得混合溶液的pH=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与氢气完全加成后,可能生成2,2,3-三甲基戊烷的烃是( )
A. CH2 ==CHCH==C(CH3)2 B. CH2==CHC(CH3)2CH(CH3)2
C. (CH3)3C-CH=CH2 D. (CH3)3CC(CH3)==CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25 gmL﹣1、质量分数为36.5%的浓盐酸配制240 mL 0.1 molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为________________________。
(2)配制240 mL 0.1 molL﹣1的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
__________ | __________ |
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)__________。
A.用30 mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12 cm处
(4)若实验中遇到下列情况,对配制盐酸的物质的量浓度有何影响(填“偏高”“偏低”或“不变”)
①用于稀释盐酸的烧杯未洗涤__________________________________________;
②容量瓶中原有少量蒸馏水____________________________________________;
③定容时俯视观察液面________________________________________________。
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度________________________________________;
②向容量瓶中转移溶液时不慎有溶液溅出________________________________;
③定容摇匀后发现液面下降____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com