
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
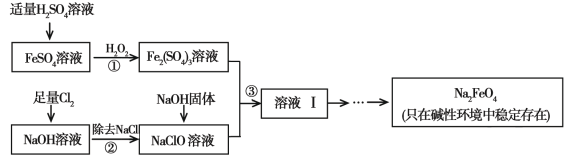
(1)高铁酸钠中铁元素的化合价为 ,次氯酸钠的电子式是________。
(2)步骤①反应的离子方程式是 。
(3)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为 。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4,其工作原理如图所示:
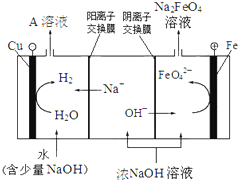
阳极的电极反应式为 。可循环使用的物质是 。
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的________倍,
【答案】(1)+6,![]() ;
;
(2)2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)Fe-6e-+8OH-=FeO42-+4H2O,NaOH溶液;(5)0.64。
【解析】
试题分析:(1)高铁酸钠中O显-2价,Na显+1价,化合价代数和为0,因此铁的价态是+6价,次氯酸钠属于离子化合物,其电子式为:![]() ;(2)利用过氧化氢的强氧化性,把Fe2+氧化成Fe3+,本身被还原成H2O,因此离子反应方程式为:2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O;(3)根据题目信息,NaClO把Fe2(SO4)3氧化成Na2FeSO4,本身被还原成NaCl,根据化合价的升降进行配平,其离子反应反应式为:2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O;(4)根据工作原理,阳极反应是Fe和OH-反应生成FeO42-,因此电极反应式为:Fe - 6e- + 8OH- =FeO42- + 4H2O,阴极反应式为2H2O+2e-=H2↑+2OH-,总电解反应式为Fe+2OH-+2H2O =FeO42-+3H2↑,阴极产生NaOH,因此NaOH循环使用;(5)FeO42-→Fe3+,单位质量得到电子是3/166=0.018,Cl2→Cl-,单位质量得到电子2/71=0.028,消毒效率为0.018/0.028=0.64。
;(2)利用过氧化氢的强氧化性,把Fe2+氧化成Fe3+,本身被还原成H2O,因此离子反应方程式为:2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O;(3)根据题目信息,NaClO把Fe2(SO4)3氧化成Na2FeSO4,本身被还原成NaCl,根据化合价的升降进行配平,其离子反应反应式为:2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O;(4)根据工作原理,阳极反应是Fe和OH-反应生成FeO42-,因此电极反应式为:Fe - 6e- + 8OH- =FeO42- + 4H2O,阴极反应式为2H2O+2e-=H2↑+2OH-,总电解反应式为Fe+2OH-+2H2O =FeO42-+3H2↑,阴极产生NaOH,因此NaOH循环使用;(5)FeO42-→Fe3+,单位质量得到电子是3/166=0.018,Cl2→Cl-,单位质量得到电子2/71=0.028,消毒效率为0.018/0.028=0.64。


科目:高中化学 来源: 题型:
【题目】今有0.1mol/LNa2SO4溶液300 mL,0.1mol/LMgSO4溶液200 mL和0.1mol/L Al2(SO4)3溶液100 mL,这三种溶液中硫酸根离子浓度之比是( )
A.1∶1∶1 B.3∶2∶2 C.3∶2∶3 D. 1∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2用途很广,它是一种广泛应用的氧化剂。例如将它加入熔态的玻璃中,可以除去带色的杂质(硫化物或亚铁盐),称为普通玻璃的“漂白剂”。在锰-锌干电池中用作去极剂,以氧化在电极上产生的氢。
(1)Zn- MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。其电解质溶液呈________性(填“酸”、“碱”或“中”),原因是_________________、________________(用离子方程式表示);该电池工作时,电子流向__________极(填“正”或 “负”)。
(2)工业上,常以菱锰矿(主要成分MnCO3,常含有少量铁、钙、锌等元素)为原料,用电解法可以制备MnO2。其制备过程如下:

写出酸浸的主要化学方程式:______________________。
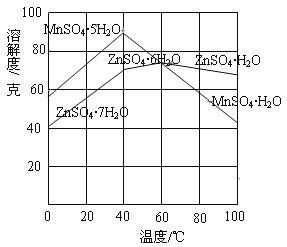
②下图可以看出,从MnSO4和ZnSO4混合溶液中结晶MnSO4·H2O晶体,需要控制的温度范围为______________(填字母)。
A.0~40℃ B.40~60℃ C.60℃以上
③请写出用惰性电极电解MnSO4溶液制备MnO2的阳极反应:___________________。
④该工艺产生的废水中含有较多的Mn2+,通常用H2S或者Na2S溶液处理。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
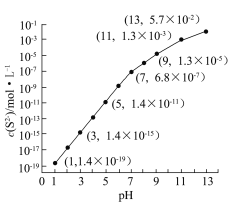
i.pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
ii.某溶液含x mol·L-1 Mn2+、0.10 mol·L-1 H2S,当调节溶液pH=5时,Mn2+开始沉淀,则x= 。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
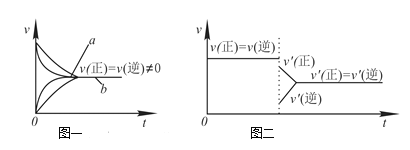
A.Na2S2O3+2HCl==2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动
B.若在恒容容器中发生反应:N2+3H2![]() 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动
2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动
C.在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率—时间图像可用图一表示
D.若在恒压容器中发生反应:2SO3![]() 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示
2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应 A(g) + 3B(g) ![]() 2C(g) 达到平衡的标志是
2C(g) 达到平衡的标志是
A.单位时间内生成n mol A,同时生成3n molB
B.单位时间内生成3nmolC,同时生成2nmolB
C.A、B、C的浓度相等
D.A、B、C的分子数比为1:3:2[
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2+O2![]() 2NO在恒容密闭容器中进行,达到平衡后,充入N2,下列说法正确的是
2NO在恒容密闭容器中进行,达到平衡后,充入N2,下列说法正确的是
A. 平衡向逆反应方向移动,N2和O2的转化率都减小
B. 平衡向正反应方向移动,N2和O2的转化率都增大
C. 压强增大平衡不移动,N2的转化率不变
D. 平衡向正反应方向移动,N2的转化率减小,O2的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com