
【题目】在一定温度下,可逆反应 A(g) + 3B(g) ![]() 2C(g) 达到平衡的标志是
2C(g) 达到平衡的标志是
A.单位时间内生成n mol A,同时生成3n molB
B.单位时间内生成3nmolC,同时生成2nmolB
C.A、B、C的浓度相等
D.A、B、C的分子数比为1:3:2[
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:X2 (g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 放热46.3 kJ |
② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
下列叙述不正确的是 ( )
A.容器①中达到平衡时,Y2的转化率为50%
B.Q=27.78 kJ
C.相同温度下;起始时向容器中充入1.0 X2 mol 、3.0 mol Y2和2 mol XY3;反应达到平衡前v(正)>v(逆)
D.容器①、②中反应的平衡常数相等,K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 油脂会造成人体肥胖,所以不能食用
B. 脂肪酸在体内可以被氧化从而供给人体热量
C. 摄入人体的脂肪大部分成为脂肪组织存在于人体内
D. 必需脂肪酸在体内有促进发育、维持健康和参与胆固醇代谢的生理功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
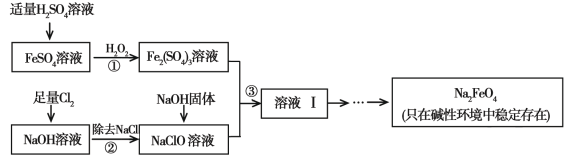
(1)高铁酸钠中铁元素的化合价为 ,次氯酸钠的电子式是________。
(2)步骤①反应的离子方程式是 。
(3)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为 。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4,其工作原理如图所示:
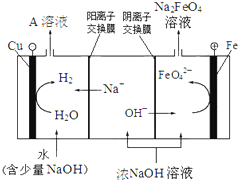
阳极的电极反应式为 。可循环使用的物质是 。
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的________倍,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是( )
A. 乙烯使溴水褪色 B. 甲烷与氯气在光照条件下的反应
C. 苯和液溴在铁作催化剂的条件下反应 D. 点燃乙烯出现黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.糖类化合物也可称为碳水化合物
B.维生素D可促进人体对钙的吸收
C.蛋白质是仅由碳、氢、氧元素组成的物质
D.硒是人体必需的微量元素,但不宜摄入过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。完成下列各题:
CH3OH(g)。完成下列各题:
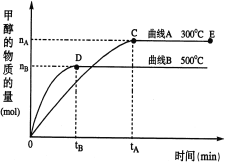
(1)反应达到平衡时,平衡常数表达式:K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,v(H2)= ;(用如图中出现的字母表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 (填序号);
a.H2的浓度减少
b.CH3OH的物质的量增加
c.正反应速率加快,逆反应速率也加快
d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述均正确且Ⅰ、Ⅱ两者间有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 工业合成氨的反应在高温下进行 | N2+3H2 |
B | 明矾水溶液水解生成胶体 | 明矾可用于净水 |
C | SiO2是酸性氧化物 | HF溶液不能用玻璃试剂瓶盛放 |
D | 氯的非金属性比碘强 | 酸性:氢碘酸强于盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com