
【题目】MnO2用途很广,它是一种广泛应用的氧化剂。例如将它加入熔态的玻璃中,可以除去带色的杂质(硫化物或亚铁盐),称为普通玻璃的“漂白剂”。在锰-锌干电池中用作去极剂,以氧化在电极上产生的氢。
(1)Zn- MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。其电解质溶液呈________性(填“酸”、“碱”或“中”),原因是_________________、________________(用离子方程式表示);该电池工作时,电子流向__________极(填“正”或 “负”)。
(2)工业上,常以菱锰矿(主要成分MnCO3,常含有少量铁、钙、锌等元素)为原料,用电解法可以制备MnO2。其制备过程如下:

写出酸浸的主要化学方程式:______________________。
②下图可以看出,从MnSO4和ZnSO4混合溶液中结晶MnSO4·H2O晶体,需要控制的温度范围为______________(填字母)。
A.0~40℃ B.40~60℃ C.60℃以上
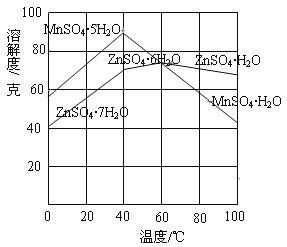
③请写出用惰性电极电解MnSO4溶液制备MnO2的阳极反应:___________________。
④该工艺产生的废水中含有较多的Mn2+,通常用H2S或者Na2S溶液处理。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
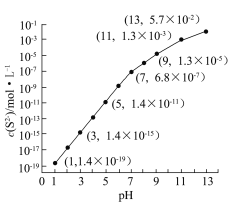
i.pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
ii.某溶液含x mol·L-1 Mn2+、0.10 mol·L-1 H2S,当调节溶液pH=5时,Mn2+开始沉淀,则x= 。[已知:Ksp(MnS)=2.8×10-13]
【答案】(1)酸,NH4++H2O![]() NH3﹒H2O+H+,
NH3﹒H2O+H+,
Zn2++2H2O![]() Zn(OH)2+2H+,正;
Zn(OH)2+2H+,正;
(2)①MnCO3+H2SO4===MnSO4+H2O+CO2↑;②C;
③Mn2+-2e-+2H2O===MnO2+4H+;④0.043,0.020。
【解析】
试题分析:(1)ZnCl2和NH4Cl都属于强酸弱碱盐,Zn2+和NH4+发生水解,Zn2++2H2O![]() Zn(OH)2+2H+、NH4++H2O
Zn(OH)2+2H+、NH4++H2O![]() NH3·H2O+H+,造成溶液中c(H+)>c(OH-),溶液显酸性,根据原电池的工作原理,电子从负极流向正极;(2)①菱锰矿成分是MnCO3,和硫酸反应:MnCO3+H2SO4=MnSO4+H2O+CO2↑;②根据溶解度和温度的关系,得到MnSO4·H2O,温度控制在60℃以上,因为随温度升高MnSO4·H2O的溶解度降低,析出MnSO4·H2O,故选项C正确;③阳极是失去电子,化合价升高,因此阳极反应式为Mn2++2H2O-2e-=MnO2+4H+;④根据物料守恒,c(S2-)+c(HS-)+c(H2S)=0.1,pH=13时,溶液中c(S2-)=5.7×10-2mol·L-1,因此c(HS-)+c(H2S)=0.043mol·L-1,根据溶度积的表示,Ksp=c(Mn2+)×c(S2-),pH=5时,c(S2-)=1.4×10-11mol·L-1,因此c(Mn2+)=0.020mol·L-1。
NH3·H2O+H+,造成溶液中c(H+)>c(OH-),溶液显酸性,根据原电池的工作原理,电子从负极流向正极;(2)①菱锰矿成分是MnCO3,和硫酸反应:MnCO3+H2SO4=MnSO4+H2O+CO2↑;②根据溶解度和温度的关系,得到MnSO4·H2O,温度控制在60℃以上,因为随温度升高MnSO4·H2O的溶解度降低,析出MnSO4·H2O,故选项C正确;③阳极是失去电子,化合价升高,因此阳极反应式为Mn2++2H2O-2e-=MnO2+4H+;④根据物料守恒,c(S2-)+c(HS-)+c(H2S)=0.1,pH=13时,溶液中c(S2-)=5.7×10-2mol·L-1,因此c(HS-)+c(H2S)=0.043mol·L-1,根据溶度积的表示,Ksp=c(Mn2+)×c(S2-),pH=5时,c(S2-)=1.4×10-11mol·L-1,因此c(Mn2+)=0.020mol·L-1。


科目:高中化学 来源: 题型:
【题目】欲配制100mL 1.0mol/LNa2SO4 溶液,下列说法正确的是( )
① 将14.2gNa2SO4溶于100mL水中
② 将20mL 5.0mol/L Na2SO4溶液用水稀释至100mL
③ 定容时俯视容量瓶刻度线导致浓度偏大
④ 摇匀后发现液面低于刻度线猫再加水至刻度线
A. ②④ B. ②③ C. ①③ D. 以上都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3 B.Na2O2、Na2CO3
C.NaOH、Na2CO3 D.Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 油脂会造成人体肥胖,所以不能食用
B. 脂肪酸在体内可以被氧化从而供给人体热量
C. 摄入人体的脂肪大部分成为脂肪组织存在于人体内
D. 必需脂肪酸在体内有促进发育、维持健康和参与胆固醇代谢的生理功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4、和A12(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)
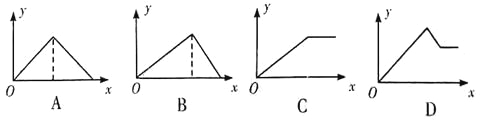
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
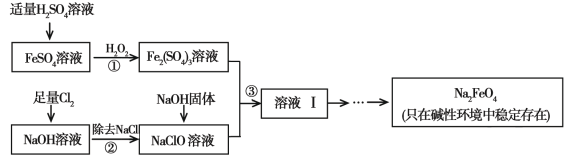
(1)高铁酸钠中铁元素的化合价为 ,次氯酸钠的电子式是________。
(2)步骤①反应的离子方程式是 。
(3)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为 。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4,其工作原理如图所示:
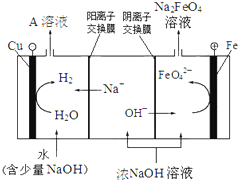
阳极的电极反应式为 。可循环使用的物质是 。
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的________倍,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.糖类化合物也可称为碳水化合物
B.维生素D可促进人体对钙的吸收
C.蛋白质是仅由碳、氢、氧元素组成的物质
D.硒是人体必需的微量元素,但不宜摄入过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是温度和压强对反应:X+Y ![]() 2Z 影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z 影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
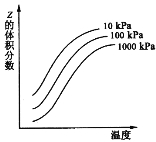
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com