
【题目】欲配制100mL 1.0mol/LNa2SO4 溶液,下列说法正确的是( )
① 将14.2gNa2SO4溶于100mL水中
② 将20mL 5.0mol/L Na2SO4溶液用水稀释至100mL
③ 定容时俯视容量瓶刻度线导致浓度偏大
④ 摇匀后发现液面低于刻度线猫再加水至刻度线
A. ②④ B. ②③ C. ①③ D. 以上都不对
科目:高中化学 来源: 题型:
【题目】某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:

下列有关叙述中不正确的是( )
A. Z结构中有4个手性碳原子
B. Y的分子式为C9H8O3
C. 1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH
D. Z与浓溴水既能发生取代反应又能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型的无机非金厲材料,工业上可通过如下反应合成: Al2O3+N2+ 3C![]() 2AlN+3CO,下列说法不正确的是 ( )
2AlN+3CO,下列说法不正确的是 ( )
A. Al2O3既不是氧化剂也不是还原剂 B. 氧化剂与还原剂物质的量比是1:3
C. AlN是还原产物 D. 每生成1molAlN有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2用途很广,它是一种广泛应用的氧化剂。例如将它加入熔态的玻璃中,可以除去带色的杂质(硫化物或亚铁盐),称为普通玻璃的“漂白剂”。在锰-锌干电池中用作去极剂,以氧化在电极上产生的氢。
(1)Zn- MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。其电解质溶液呈________性(填“酸”、“碱”或“中”),原因是_________________、________________(用离子方程式表示);该电池工作时,电子流向__________极(填“正”或 “负”)。
(2)工业上,常以菱锰矿(主要成分MnCO3,常含有少量铁、钙、锌等元素)为原料,用电解法可以制备MnO2。其制备过程如下:

写出酸浸的主要化学方程式:______________________。
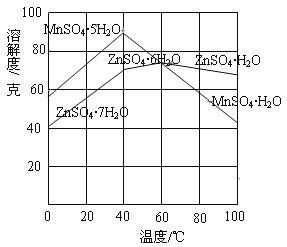
②下图可以看出,从MnSO4和ZnSO4混合溶液中结晶MnSO4·H2O晶体,需要控制的温度范围为______________(填字母)。
A.0~40℃ B.40~60℃ C.60℃以上
③请写出用惰性电极电解MnSO4溶液制备MnO2的阳极反应:___________________。
④该工艺产生的废水中含有较多的Mn2+,通常用H2S或者Na2S溶液处理。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
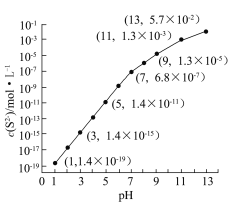
i.pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
ii.某溶液含x mol·L-1 Mn2+、0.10 mol·L-1 H2S,当调节溶液pH=5时,Mn2+开始沉淀,则x= 。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com