
【题目】A、B、C、D、E、 F、G、H是周期表中前四周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
H | H是与D相邻的同主族元素,且原子半径:H>D |
(1) B元素符号为________ ,A与C以原子个数比为1:1形成的化合物的电子式为_______ ,用电子式表示C与E形成化合物的过程________ 。
(2) A、C、E所形成简单离子半径由大到小的顺序是____________ ,H的最高价氧化物对应水化物的化学式为_________ ,A、D、H的氢化物的沸点由高到低的顺序为____________________ 。
(3) 非金属性D_________ E(填“大于”或“小于”)。下列事实能证明这一结论的是________ (选填字母序号)。
a.E的熔点低于D
b.氢化物的还原性:D > E
c.最高价氧化物对应的水化物酸性:E > D
d.氢化物的酸性:E >D
【答案】Al ![]()
![]() Cl->O2->Na+ H2SeO4 H2O>H2Se>H2S 小于 b c
Cl->O2->Na+ H2SeO4 H2O>H2Se>H2S 小于 b c
【解析】
A、B、C、D、E、F、G、H是周期表中前四周期的七种元素,A是地壳中含量最多的元素,则A为O元素,B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的,则B为Al元素,C与B同周期,且是所在周期中原子半径最大的(稀有气体除外),则C为Na元素,D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味,则D为S元素,E与D同周期,且在该周期中原子半径最小,则E为Cl元素,F的氢化物和最高价氧化物的水化物反应生成一种离子化合物,则F为N元素,G是形成化合物种类最多的元素,则G为C元素,H是与D相邻的同主族元素,且原子半径:H>D,则H为Se元素,据此分析解答问题。
根据上述分析可知,A为O元素,B为Al元素,C为Na元素,D为S元素,E为Cl元素,F为N元素,G为C元素,H为Se元素;
(1)B为元素铝,元素符号为Al,O与Na以原子个数比为1:1形成的化合物为Na2O2,为离子化合物,其电子式为![]() ,Na与Cl形成的化合物为NaCl,其形成过程为
,Na与Cl形成的化合物为NaCl,其形成过程为![]() ,故答案为:Al;
,故答案为:Al;![]() ;
;![]() ;
;
(2)离子的核外电子层数越多,半径越大,电子层数相同时,核电荷数越小,半径越大,Cl-的核外电子层数为3层,O2-、Na+的核外电子层数为2层,核电荷数O<Na,则离子半径:Cl->O2->Na+,H的最高价氧化物对应水化物的化学式为H2SeO4,H2O分子间形成氢键,沸点最高,H2Se和H2S均为分子晶体,相对分子质量H2Se>H2S,则范德华力H2Se>H2S,因此沸点:H2O>H2Se>H2S,故答案为:Cl->O2->Na+;H2SeO4;H2O>H2Se>H2S;
(3)S和Cl为同一周期元素,同周期元素从左至右非金属性依次增强,故非金属性S<Cl,
a.熔点属于物理性质、不能判断元素非金属性的强弱;
b.氢化物的还原性越弱,则元素的非金属越强;
c.最高价氧化物对应水化物的酸性越强,非金属性越强;
d.不能用氢化物的酸性判断非金属性的强弱;
即bc可证明这一结论,故答案为:小于;bc。


科目:高中化学 来源: 题型:
【题目】下列对古文献记载内容理解错误的是
A.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐
B.《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和槽入甑,蒸令气上![]() 其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
C.《本草经集注》有记载:“以火烧之、紫青烟起,乃真硝石也”,区分硝石(KNO3)和朴硝(Na2SO4),该方法利用了焰色反应
D.《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对硝酸钾提取涉及到升华操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置从海水中提取CO2,有利于减少环境中温室气体的含量。下列说法正确的是
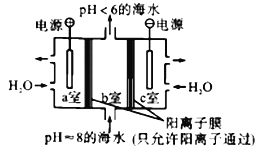
A. 通电后,a室的pH增大
B. 中间隔室发生的反应:HCO3-+H+==CO2↑+H2O,从而提取CO2
C. 阴极反应式为2H+-2e-==H2↑
D. 当电路中通过1mol电子的电量时,会有22.4LCO2气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应,与硫酸型酸雨的形成肯定无关的是( )
A.SO2+2H2S=3S+2H2OB.SO2+H2O![]() H2SO3
H2SO3
C.2SO2+O2![]() 2SO3D.SO3+H2O=H2SO4
2SO3D.SO3+H2O=H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油化学工业最重要的基础原料,经乙烯为原料可以制得许多工业材料和日用品。乙烯能发生下列转化关系:
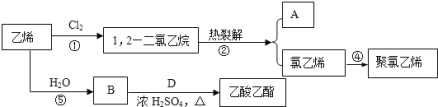
(1)A的分子式为____________,化合物D的官能团名称是_____________。
(2)写出反应①、④的化学方程式:
①__________;
④__________。
(3)上述反应中,以生成有机产物为目标,原子利用率100%的反应有_________________。
(4)实验室用B与D制备乙酸乙酯的化学方程式是______,浓硫酸的作用是_______ ,分离提纯产品所用的试剂是________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g氯化氢溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为m,物质的量浓度为c mol/L,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A.所得溶液的物质的量浓度为1mol/L
B.36.5 g氯化氢含有NA个原子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数为=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__个电子层,最外层有__个电子,写出砷原子最外层电子的轨道表示式:__。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__(用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__强于__(填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
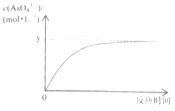
①写出该反应平衡常数的表达式K=___。
②不能判断反应达到平衡状态的是___(选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是我校实验室化学试剂浓硫酸试剂标签上的部分内容。

现用该浓硫酸配制480mL1molL1的稀硫酸。可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒。请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有______(写仪器名称)。
(2)经计算,所需浓硫酸的体积约为______mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数______49%(填“>”、“<”或“=”)。
(3)对所配制的稀硫酸进行测定,发现其浓度大于1molL1,配制过程中下列各项操作可能引起该误差的原因______。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③将稀释后的稀硫酸立即转入容量瓶后,立即进行后面的实验操作
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
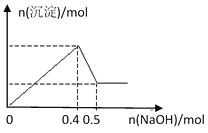
A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com