
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
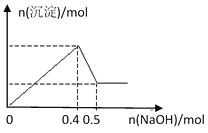
A. 1:3B. 1:6
C. 2:3D. 3:2
【答案】C
【解析】
由图可知加入0.4molNaOH,沉淀达最大量,沉淀为氢氧化镁、氢氧化铝,根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH-)=0.4mol,加入0.5molNaOH时,沉淀由最大值减小为最小值,故0.1molNaOH溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.1mol,所以2n[Mg(OH)2]+3×0.1mol=0.4mol,故n[Mg(OH)2]=0.05mol,根据化学式MgCl2可知溶液中n(Cl-)=2n[Mg(OH)2]=2×0.05mol=0.1mol,根据化学式Al2(SO4)3可知溶液中n(SO42-)=![]() n[Al(OH)3]=
n[Al(OH)3]= ![]() ×0.1mol=0.15mol,所以原溶液中Cl-与SO42-的物质的量之比为0.1mol:0.15mol=2:3;
×0.1mol=0.15mol,所以原溶液中Cl-与SO42-的物质的量之比为0.1mol:0.15mol=2:3;
故选:C。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、 F、G、H是周期表中前四周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
H | H是与D相邻的同主族元素,且原子半径:H>D |
(1) B元素符号为________ ,A与C以原子个数比为1:1形成的化合物的电子式为_______ ,用电子式表示C与E形成化合物的过程________ 。
(2) A、C、E所形成简单离子半径由大到小的顺序是____________ ,H的最高价氧化物对应水化物的化学式为_________ ,A、D、H的氢化物的沸点由高到低的顺序为____________________ 。
(3) 非金属性D_________ E(填“大于”或“小于”)。下列事实能证明这一结论的是________ (选填字母序号)。
a.E的熔点低于D
b.氢化物的还原性:D > E
c.最高价氧化物对应的水化物酸性:E > D
d.氢化物的酸性:E >D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
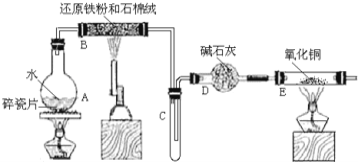
(1)装置B中发生反应的化学方程式是__________________________。
(2)装置E中的现象是_____________________________________。
(3) 该小组学生利用B装置的固体与足量盐酸反应后的滤液制取FeCl3·6H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是______________________________。
② 简述检验滤液中Fe3+的操作方法________________________。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )
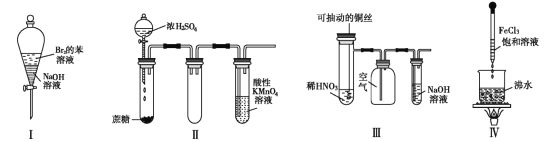
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料.工业上提取铝的工艺流程如下:
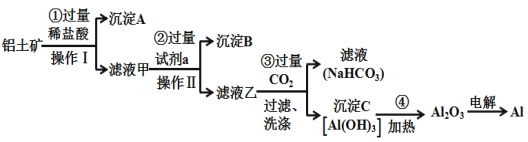
(1)沉淀A的化学式是____,沉淀B的化学式是____,滤液甲中所含金属离子是___、____,试剂a的化学式为__________;
(2)步骤③中通入过量CO2,产生沉淀C的离子方程式为___________________________________;
(3)Al2O3中所含的化学键的类型为________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其反应方程式为_____________________________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂,下列氧化物中不能与铝粉组成铝热剂的是(___________)
a.MgO b.V2O5 c.Fe3O4 d.MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一套制取并验证氯气部分化学性质的实验装置。
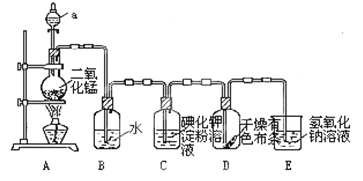
回答下列问题:反应的方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+ Cl2↑
MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a盛有的试剂为___________。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式_______________________________________________
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为______色。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
_______________________________________________________________。
(5)装置E的作用是___________。并写出该反应的化学方程式:________________。
(6)写出氯气与石灰乳制取漂白粉的化学方程式: ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示资源开发、回收、利用原理的反应方程式不正确的是( )
A.海带提碘时用酸性H2O2氧化I-:H2O2+2I-+2H+=2H2O+I2
B.将煤气化为可燃性气体:C+H2O![]() CO+H2
CO+H2
C.利用H2还原MgO冶炼金属Mg:H2+MgO![]() Mg+H2O
Mg+H2O
D.可以用铝和氧化铁制备铁单质:2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为_________,碳原子和氧原子的个数比为________ ,该混合气体的摩尔质量为__________ 。
(2)12.4g含Na2X中含Na+0.4mol,则Na2X的摩尔质量是________ ,X的相对原子质量是____________。
(3)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L人造空气的质量是4.8g,其中氧气和氦气的分子数之比是_____________,氧气的质量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答问题。
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因_________;农业上用石膏降低其碱性的反应原理____________。
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-向水中加NaHSO4固体,水的电离平向________移动,且所得溶液显_____性。
H3O++OH-向水中加NaHSO4固体,水的电离平向________移动,且所得溶液显_____性。
(3)若取 pH、体积均相等的NaOH和氨水分别加水稀释 m倍、n稀释后pH仍相等,则 m______n(填“>”“<”或“=”);
(4)常温下,在pH=6的CH3COOH与CH3COONa 的混合溶液中水电离出来的c(OH-)=_________;
(5)在如图坐标纸上画出用0.1000mol/LNaOH滴定20.00mL0.1000mol/LHCl的滴定曲线示意图。
 ______
______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com