
【题目】下图是一套制取并验证氯气部分化学性质的实验装置。
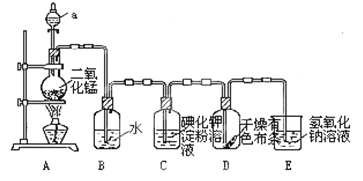
回答下列问题:反应的方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+ Cl2↑
MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a盛有的试剂为___________。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式_______________________________________________
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为______色。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
_______________________________________________________________。
(5)装置E的作用是___________。并写出该反应的化学方程式:________________。
(6)写出氯气与石灰乳制取漂白粉的化学方程式: ___________________。
【答案】浓盐酸 < Cl2+H2OHCl+HClO 蓝色 能,因为湿润的氯气有漂白性 吸收多余的氯气 Cl2+2NaOH=NaCl+NaClO+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
(1)反应原理为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,故分液漏斗中装的是浓盐酸;
(2)由于反应Cl2+H2OHCl+HClO生成了酸,故溶液呈酸性,pH<7;
(3)由于反应生成碘单质:Cl2+2I-=2Cl-+I2,使淀粉呈蓝色;
(4)由于氯气为湿润的,故有次氯酸生成,具有漂白性,干燥的有色布条能褪色;
(5)氯气有毒,一般用碱液吸收:Cl2+2NaOH=NaCl+NaClO+H2O;
(6)用氯气与石灰乳制取漂白粉,化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


科目:高中化学 来源: 题型:
【题目】36.5 g氯化氢溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为m,物质的量浓度为c mol/L,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A.所得溶液的物质的量浓度为1mol/L
B.36.5 g氯化氢含有NA个原子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数为=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一固定容积的密闭容器中进行反应:A2 +B2![]() 2AB。该条件下,A2、B2、AB均为气体。下列情况一定能说明该反应已达到化学平衡状态的是( )
2AB。该条件下,A2、B2、AB均为气体。下列情况一定能说明该反应已达到化学平衡状态的是( )
A. 气体的密度不再改变时
B. 气体的总物质的量不再改变时
C. 混合气体中各组分的含量不再改变时
D. 每消耗1molB2同时有2molAB生成时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
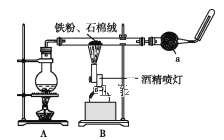

(1)已知该实验反应的反应方程式为:__Fe+__H2O![]() __Fe3O4+__H2(请配平)。
__Fe3O4+__H2(请配平)。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用图中__(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.448L,则铁粉的转化率为___。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②___ | Ⅲ.反应后的溶液中阳离子___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为___色 | ①___ ②Fe2++2OH—=Fe(OH)2↓ ③4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
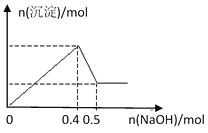
A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )

A.Fe2+的氧化率随时间延长而逐渐增大
B.由①和③可知,温度越高,Fe2+氧化速率越快
C.由②和③可知,pH越大,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将4molNH3和4molO2混合于固定容积为2L的密闭容器中,发生反应:4NH3(g)+5O2(g)=4X(g)+6H2O(g)。2min后该反应达到平衡,生成3molH2O。则:
(1)X的化学式为___。
(2)O2的转化率为___(O2转化率=已反应的O2的量/O2的总量×100%)。
(3)0~2min内,v(NH3)=___mol·L-1·min-1。
(4)燃料电池是一种高效、环境友好型发电装置。一种燃料电池的电解质溶液为NaOH溶液,负极通入NH3,正极通入空气,产物对环境无污染,则负极的电极反应式为___,电路中每通过1mol电子,消耗标准状况下的空气___(假设空气中O2的含量为20%)L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) →Fe(s)+CO2(g)-Q,已知1100℃时,K=0.263
(1)写出该反应的平衡常数表达式____。温度升高,化学平衡移动后达到新的平衡,高炉中CO2和CO的体积比值___,平衡常数K值___(以上选填“增大”、“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0025mol/L、c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态___(选填“是”或“否”),此时,化学反应速率是v正___v逆(选填“大于”、“小于”或“等于”),其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将28L HCl气体溶液在水中配成250mL盐酸溶液
(1)求所得盐酸的物质的量浓度;
(2)若取此溶液50mL再稀释成1L溶液,求稀释后盐酸的物质的量浓度;
(3)若用KMnO4氧化该盐酸溶液制氯气,反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,
若产生的Cl2在标准状况下的体积为672mL,则被氧化的HCl的物质的量.(要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com