
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )

A.Fe2+的氧化率随时间延长而逐渐增大
B.由①和③可知,温度越高,Fe2+氧化速率越快
C.由②和③可知,pH越大,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】工业上常采取以下方法除去H2S和SO2以减少有害气体的排放。完成下列填空:
I.H2S的除去
用Fe2(SO4)3溶液吸收H2S生成FeSO4。FeSO4被O2氧化使Fe2(SO4)3再生,其原理为:□FeSO4+□O2+□H2SO4![]() □Fe2(SO4)3+□ 。
□Fe2(SO4)3+□ 。
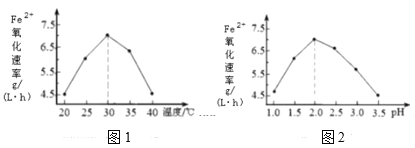
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍。由图1和图2判断,使用硫杆菌的最佳条件为__;若反应温度过高,反应速率下降,其原因是__。
(2)补全、配平Fe2(SO4)3再生的化学方程式,并标出电子转移的数目和方向。______。
(3)在一定条件下,也可以用H2O2氧化H2S,其氧化产物随参加反应的n(H2O2)/n(H2S)变化而不同,当n(H2O2)/n(H2S)=4时,氧化产物的化学式为__。
II.SO2的除去
用NaOH溶液吸收SO2,并用CaO使NaOH再生:NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:___。
(5)CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理____。
Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理____。
(6)也可用氨水除去SO2。某废气含0.2%SO2和10%SO2(体积含量,其余为N2),一定条件下,该废气以5m3/h的速率通过催化剂与速率为20L/h的NH3混合,再喷水,得到(NH4)2SO4晶体(气体体积均已折算为标准状况)。通过计算说明NH3速率控制在20L/h的原因。________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷(![]() )是其中的一种。下列关于该化合物的说法不正确的是( )
)是其中的一种。下列关于该化合物的说法不正确的是( )
A. 与环庚烯互为同分异构体B. 二氯代物共有8种(不含立体异构)
C. 所有碳原子不可能处在同一平面D. 1mol该化合物含有18mol共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性的气体杂质,由此他提出必须先除去杂质,然后再使乙烯与溴水反应。
请你回答下列问题:
(1)甲同学的实验中有关的化学方程式为___________。
(2)甲同学设计的实验____(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是____。
①使溴水褪色的反应,未必是加成反应 ②使溴水褪色的反应,就是加成反应
③使溴水褪色的物质,未必是乙烯 ④使溴水褪色的物质,就是乙烯
(3)乙同学推测此乙烯中必定含有的一种杂质气体是____。在验证过程中必须全部除去杂质气体,除去该杂质的试剂可选用________。
(4)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取的方法有________。
II.探究苯与溴发生反应的原理用如图所示装置进行实验并分离提纯反应的产物。请回答下列问题:
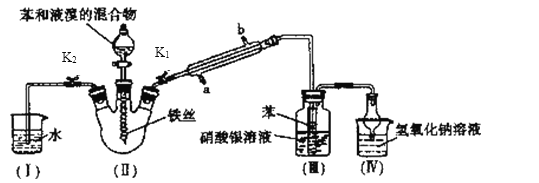
(1)冷凝管所起的作用为冷凝回流和导气,冷凝水从______口进入(填“a或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。 Ⅲ中小试管内苯的作用是_____________。能说明苯与液溴发生了取代反应的现象是_____________。Ⅳ中球形干燥管的作用是_________________。
(3)欲结束实验时,需进行的操作为:待三颈烧瓶中的反应进行到仍有气泡冒出时,关闭分液漏斗活塞,再___________(填有关K1、K2的操作)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一套制取并验证氯气部分化学性质的实验装置。
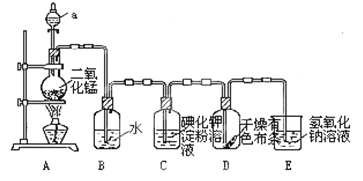
回答下列问题:反应的方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+ Cl2↑
MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a盛有的试剂为___________。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式_______________________________________________
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为______色。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
_______________________________________________________________。
(5)装置E的作用是___________。并写出该反应的化学方程式:________________。
(6)写出氯气与石灰乳制取漂白粉的化学方程式: ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于密闭容器中进行的可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列说法中可以充分说明这反应已经达到化学平衡状态的是
2SO3(g),下列说法中可以充分说明这反应已经达到化学平衡状态的是
A.SO2、O2、SO3的浓度比为2:1:2B.SO2、O2、SO3在密闭容器中共存
C.SO2、O2、SO3的浓度不再发生变化D.反应停止,正、逆反应速率都等于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 11.2L氧气与臭氧的混合气体中含NA个氧原子
B. 60gSiO2晶体中含有2NA个Si—O键
C. 常温下,20LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA
D. 标准状况下,22.4LSO2的中心原子所含有的孤电子对数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A在一定温度下有分解反应A (s) = B(s) + C(g) + 4D(g),若测得生成的气体的质量是同温压下,相同体积氢气的10倍,且当所生成的气体在标况下的体积为22.4L时,所得B的质量为30.4g,A的摩尔质量为( )
A.120.4g/molB.50.4g/molC.182.4g/molD.252g/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com