
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 11.2L氧气与臭氧的混合气体中含NA个氧原子
B. 60gSiO2晶体中含有2NA个Si—O键
C. 常温下,20LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA
D. 标准状况下,22.4LSO2的中心原子所含有的孤电子对数为2NA
【答案】C
【解析】
A.气体状况未知,气体摩尔体积未知;
B.1molSiO2晶体存在4molSi-O键;
C. pH=12的Na2CO3溶液中c(H+)=10-12mol/L,根据水的离子积计算溶液中c(OH-),再根据n=cV计算n(OH-),根据N=nNA计算OH-离子数目;
D.1molSO2含有1mol孤电子对。
A.气体状态未知,无法确定气体的物质的量,选项A错误;
B、1molSiO2中有4molSi-O键,60gSiO2中含有Si-O键的物质的量为![]() mol=4mol,即4NA个Si—O键,选项B正确;
mol=4mol,即4NA个Si—O键,选项B正确;
C.pH=12的Na2CO3溶液中c(H+)=10-12mol/L,故溶液中c(OH-)=![]() =0.01mol/L,溶液中n(OH-)=20L×0.01mol/L=0.2mol,OH-离子数目为0.2mol×NAmol-1=0.2NA,选项C正确;
=0.01mol/L,溶液中n(OH-)=20L×0.01mol/L=0.2mol,OH-离子数目为0.2mol×NAmol-1=0.2NA,选项C正确;
D.标准状况下,22.4LSO2的物质的量是1mol,1molSO2含有1mol孤电子对,选项D错误;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
⑴若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)=________L,V(H2)=________L.
⑵若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )

A.Fe2+的氧化率随时间延长而逐渐增大
B.由①和③可知,温度越高,Fe2+氧化速率越快
C.由②和③可知,pH越大,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上,对过氧化氢的分子结构有过不同观点,下图两种对结构的猜测中有一种正确,请选用合理实验加以证明
猜想Ⅰ: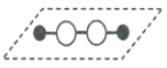 猜想Ⅱ:
猜想Ⅱ: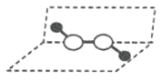
A.测定过氧化氢的沸点
B.测定过氧化氢分解时吸收的能量
C.测定过氧化氢分子中的氢氧键与氧氧键键长
D.观察过氧化氢细液流在电场中是否发生偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) →Fe(s)+CO2(g)-Q,已知1100℃时,K=0.263
(1)写出该反应的平衡常数表达式____。温度升高,化学平衡移动后达到新的平衡,高炉中CO2和CO的体积比值___,平衡常数K值___(以上选填“增大”、“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0025mol/L、c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态___(选填“是”或“否”),此时,化学反应速率是v正___v逆(选填“大于”、“小于”或“等于”),其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下化学反应的离子方程式书写正确的是( )
A. H2CO3电离:H2CO3![]() CO32-+2H+
CO32-+2H+
B. 将少量金属钠放入冷水中:Na+2H2O=Na+ +2OH-+H2↑
C. C12溶解于水:Cl2+H2O![]() 2H++ClO- +Cl-
2H++ClO- +Cl-
D. 向CuSO4溶液中通入H2S:Cu2+ +H2S=CuS↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中:互为同分异构体的是___,互为同系物的是__,属于同一种物质的是___。
A.CH3CH2CH3、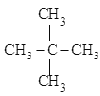 B.CH3-CH=CH-CH3、CH2=CH-CH2-CH3 C.CH2=CH-CH3、C2H4 D.
B.CH3-CH=CH-CH3、CH2=CH-CH2-CH3 C.CH2=CH-CH3、C2H4 D.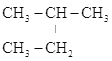 、
、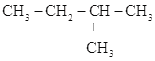 E.CH3CH2CH2COOH、CH3COOCH2CH3
E.CH3CH2CH2COOH、CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式并用双线桥法表示电子转移的方向和数目:______________。
(2)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:________。
(3)工业上制漂白粉的化学方程式为____________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是_________。
(4)KAl(SO4)2·12H2O因其溶于水生成_____(化学式)可以吸附杂质,从而达到净水作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为CO(g)+2H2(g)=CH3OH(g) ΔH=-116kJ·mol-1。某些化学键的键能数据如表:
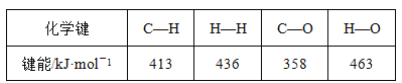
则CO中碳氧键的键能是
A.431kJ·mol-1B.946kJ·mol-1
C.1072kJ·mol-1D.1130kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com