
����Ŀ���ڱ�״���£���28L HCl������Һ��ˮ�����250mL������Һ
��1����������������ʵ���Ũ�ȣ�
��2����ȡ����Һ50mL��ϡ�ͳ�1L��Һ����ϡ�ͺ���������ʵ���Ũ�ȣ�
��3������KMnO4������������Һ����������Ӧ����ʽ���£�
2KMnO4+16HCl�T2KCl+2MnCl2+5Cl2��+8H2O��
��������Cl2�ڱ�״���µ����Ϊ672mL����������HCl�����ʵ�������Ҫ��д��������̣�
���𰸡���1��5mol/L��2��0.25mol/L����3��0.06mol
��������
(1)�ڱ�״���£�28L HCl�����ʵ���n=![]() =1.25mol��������������ʵ���Ũ��c=
=1.25mol��������������ʵ���Ũ��c=![]() =5mol/L���ʴ�Ϊ��5mol/L��
=5mol/L���ʴ�Ϊ��5mol/L��
(2)��ϡ�ͺ���������ʵ���Ũ��Ϊc1������ϡ�Ͷ��ɵ�5mol/L��0.05L=c1��1L�����c1=0.25mol/L���ʴ�Ϊ��0.25mol/L��
(3)Cl2�ڱ�״���µ����ʵ���n(Cl2)=![]() =0.03mol��������HCl�����ʵ���Ϊx����
=0.03mol��������HCl�����ʵ���Ϊx����
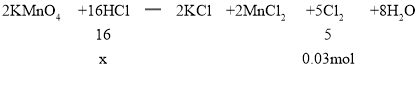
![]() �����x=0.096mol��
�����x=0.096mol��
��������HClռ��ӦHCl��![]() ����������HCl�����ʵ���Ϊ0.096mol��
����������HCl�����ʵ���Ϊ0.096mol��![]() =0.06mol��
=0.06mol��
�ʴ�Ϊ��0.06mol��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
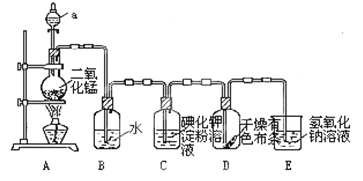
����Ŀ����ͼ��һ����ȡ����֤�������ֻ�ѧ���ʵ�ʵ��װ�á�
�ش��������⣺��Ӧ�ķ���ʽ��MnO2+4HCl��Ũ��![]() MnCl2+2H2O+ Cl2��
MnCl2+2H2O+ Cl2��
(1)װ��A�У�����aʢ�е��Լ�Ϊ___________��
(2)��Cl2����ͨ��һ��ʱ���װ��B����Һ��pHֵ____7(����������������������)��д��Cl2��ˮ��Ӧ�ķ���ʽ_______________________________________________
(3)��������Cl2����ͨ���۲쵽װ��C�е���Һ��Ϊ______ɫ��
(4)��Cl2��������ͨ��ʱ��װ��D�и������ɫ�����ܷ���ɫ��Ϊʲô��
_______________________________________________________________��
(5)װ��E��������___________����д���÷�Ӧ�Ļ�ѧ����ʽ��________________��
��6��д��������ʯ������ȡƯ�۵Ļ�ѧ����ʽ�� ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1����ͼ��ʾ���ʵ��йؽṹ����ش�
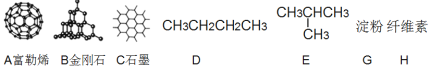
��A��B��C���ߵĹ�ϵΪ_________(��д���)��
a��ͬ���칹��b��ͬ��������c��ͬһ������d��ͬλ��
�ڹ�̬ʱ��A����__________���壨��������������ԭ������������������
����ͬѧ��ΪD��E��Ϊͬ���칹���G��H���߲�����ͬ���칹��Ĺ�ϵ����仰��ȷ�𣿴�__________����д����ȷ����������ȷ����
���л���E��ϵͳ������������������__________��
��2����֪����7�����ʣ�a��P4(����) b��SiO2 c��NH4Cl d��NaOH e��NaCl f���ɱ� g�����ʯ����̬ʱ���Ƕ�Ϊ���壬�ش��������⣺(��д���)
�پ����м������Ӽ����й��ۼ�����__________
���ۻ�ʱֻ��Ҫ�ƻ����ۼ�����__________
���۵���ߵľ�����__________���е���͵ľ�����__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H��0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±�������������⡣
2NH3(g) ��H��0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±�������������⡣
t/�� | 25 | 125 | 225 | �� |
K | 4.1��105 | K1 | K2 | �� |
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=________��K1______K2����������������������������������ѹǿʹƽ��������Ӧ�����ƶ�����ƽ�ⳣ��_________������������������������
��2���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������____________������ţ���
A��2��H2������= 3��NH3���棩 B�����������ܶȱ��ֲ���
C��������ѹǿ���ֲ��� D��N2���������ʵ���H2����������
E�������������ƽ����Է�����������ʱ����仯 F������������ɫ���ֲ���
��3������ͬ����N2��H2�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У�����������Ӧ�õ������������ݣ�
ʵ���� | �¶ȣ��棩 | ��ʼ����mol�� | ƽ������mol�� | �ﵽƽ������ʱ�䣨min�� | |
N2 | H2 | NH3 | |||
1 | 650 | 2 | 4 | 0.9 | 9 |
2 | 900 | 1 | 2 | 0.3 | 0.01 |
ʵ��1������(NH3)��ʾ�ķ�Ӧ����Ϊ______��ʵ��2�����ʱ�ʵ��1���ԭ����____________��
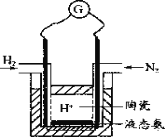
��4��������Ʋ��ø��������ӵ������SCY�մɣ��ܴ���H+����ʵ���˳�ѹ�¼��ܺϳɰ����ܷ����ʵ��װ�ã���ͼ�������������ĵ缫��ӦΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ�еĻ�ѧ��Ӧ��������ӷ�Ӧ������Ҫ��ش����⡣
��1���μ�أ����϶�Na2CO3��NaCl��������ֲ�����������û�ѧ����ʽ��ʾ���μ�ز������Ե�ԭ��_________��ũҵ����ʯ�ཱུ������Եķ�Ӧԭ��____________��
��2����֪ˮ��������ƽ�⣺H2O+H2O![]() H3O++OH-��ˮ�м�NaHSO4���壬ˮ�ĵ���ƽ��________�ƶ�����������Һ��_____�ԡ�
H3O++OH-��ˮ�м�NaHSO4���壬ˮ�ĵ���ƽ��________�ƶ�����������Һ��_____�ԡ�
��3����ȡ pH���������ȵ�NaOH�Ͱ�ˮ�ֱ��ˮϡ�� m����nϡ�ͺ�pH����ȣ��� m______n������>����<������=������
��4�������£���pH=6��CH3COOH��CH3COONa �Ļ����Һ��ˮ���������c(OH-)=_________��
��5������ͼ����ֽ�ϻ�����0.1000mol/LNaOH�ζ�20.00mL0.1000mol/LHCl�ĵζ�����ʾ��ͼ��
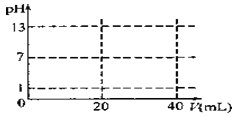 ______
______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��һ���¶����зֽⷴӦA (s) = B(s) + C(g) + 4D(g)����������ɵ������������ͬ��ѹ�£���ͬ���������10�����ҵ������ɵ������ڱ���µ����Ϊ22.4Lʱ������B������Ϊ30.4g��A��Ħ������Ϊ( )
A.120.4g/molB.50.4g/molC.182.4g/molD.252g/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ܰ뵼�����Ҫԭ�ϡ���ҵ�ϳ���п��ұ���ķ����л����ء���֪ijп������Ҫ��Zn��Si��Pb��Fe��Ga����������øÿ������صĹ����������£�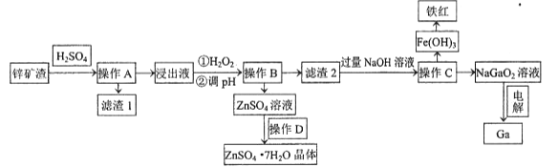
��֪��������Ԫ�����ڱ���λ�ڵ������ڵڢ�A�壬��ѧ�����������ơ�
��lg2=0.3 lg3=0.48��
�۲������ʵ�Ksp���±���ʾ��
���� | Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.6��10��17 | 2.7��10��31 | 8��10��16 | 2.8��10��39 |
(1)Ϊ�����������ʣ����ʵ���������Ũ���⣬Ӧ��ȡ�Ĵ�ʩ��__________________��д��������������1����Ҫ�ɷ�������Ǧ��_________________(д��ѧʽ)��
(2)����H2O2��Ŀ����(�����ӷ���ʽ��ʾ)______________________ ��
(3)���������£�������Һ�и������ӵ�Ũ�Ⱦ�Ϊ0.01mo/L������Һ��ij������Ũ��С��1��10-5mol/Lʱ����Ϊ����������ȫ��ȥ����pHӦ���ڵķ�ΧΪ___________________��
(4)����D������_______________���ˡ�ϴ�ӡ����
(5)��ⷨ�Ʊ������ء��ö��Ե缫���NaGaO2��Һ�����Ƶý����أ�д�������缫��Ӧʽ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100 mL FeBr2��Һ��ͨ���״����2.24 L Cl2����Һ����![]() ��Br���������ɵ���Br2����ԭFeBr2��Һ��FeBr2�����ʵ���Ũ��Ϊ(����)
��Br���������ɵ���Br2����ԭFeBr2��Һ��FeBr2�����ʵ���Ũ��Ϊ(����)
A.4 mol L-1B.![]() mol L-1C.
mol L-1C.![]() mol L-1D.
mol L-1D.![]() mol L-1
mol L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʽṹ��ʾ���ʹ��ɵİ��أ���ش��������⣺
��1��Ԫ��A����8�����ӣ�10�����ӵĺ��أ��ú��ط��ű�ʾΪ______��Ԫ��B����ѧ�ҳ�������֮��������Ԫ��Aͬ����λ�ڵ������ڣ�Ԫ��B������Ϊ______��A��B���⻯��е�ϸߵ���_____���ѧʽ����
��2��CH4�й��õ��Ӷ�ƫ��C��SiH4�й�Ԫ��Ϊ+4�ۣ���C��Si��H�ĵ縺���ɴ�С��˳��Ϊ______��
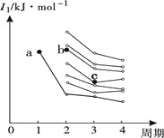
��3����ͼ��ǰ����������Ԫ�ص�һ�������ݶ�ͼ��ͼ��a���Ӧ��Ԫ��Ϊ�⣬��b���ӦԪ�ص�δ�ɶԵ�����Ϊ______��c���ӦԪ�ػ�̬ԭ�Ӽ۵����Ų�ʽΪ_______��
��4��FeC13����������ˮ���Ҵ����þƾ��Ƽ��ȼ�����������FeF3�����۵����1000�棬�Խ������ֻ������۵����ϴ��ԭ����____��
��5��ˮ���к��в�ͬ�Ĺ��ᣬ�������ʡ����ٵ�ˮ���к��������ᣬ������Ľṹ����ͼ��������ľ�������Ϊ_____��̼ԭ�ӵ��ӻ��������Ϊ_____�������ᾧ���к��е���������___________��
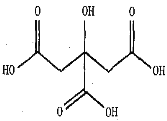
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com