
【题目】在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表,完成下列问题。
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表,完成下列问题。
t/℃ | 25 | 125 | 225 | … |
K | 4.1×105 | K1 | K2 | … |
(1)该反应的化学平衡常数表达式为K=________;K1______K2(填“>”“<”或“=”);若增大压强使平衡向正反应方向移动,则平衡常数_________(填“变”或“不变”)。
(2)判断该反应达到化学平衡状态的依据是____________(填序号):
A.2υH2(正)= 3υNH3(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.N2的消耗速率等于H2的消耗速率
E.容器中气体的平均相对分子质量不随时间而变化 F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
N2 | H2 | NH3 | |||
1 | 650 | 2 | 4 | 0.9 | 9 |
2 | 900 | 1 | 2 | 0.3 | 0.01 |
实验1中以υ(NH3)表示的反应速率为______,实验2的速率比实验1快的原因是____________;
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图)。则其正极的电极反应为_____________。
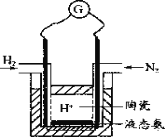
【答案】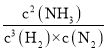 > 不变 A、C、E 0.05mol/(Lmin) 实验2温度高于实验1 N2+6e-+6H+=2NH3
> 不变 A、C、E 0.05mol/(Lmin) 实验2温度高于实验1 N2+6e-+6H+=2NH3
【解析】
(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,平衡常数计算表达式K=
2NH3(g)△H<0,平衡常数计算表达式K=  ;反应是放热反应,依据图表数据分析,温度升高,平衡逆向进行,平衡常数减小,压强增大平衡正向进行但平衡常数不变;
;反应是放热反应,依据图表数据分析,温度升高,平衡逆向进行,平衡常数减小,压强增大平衡正向进行但平衡常数不变;
(2)平衡标志最根本的依据是正反应速率等于逆反应速率,反应混合物中各组分的含量保持不变;
A、速率之比等于系数之比,2υH2(正)=3υNH3(逆),说明氨气的正反应速率等于氨气的逆反应速率,反应达到平衡,选项A符合;
B、反应体系中物质的质量始终不变,体积不变,密度始终不变,混合气体的密度保持不变不能说明反应达到平衡状态,选项B不符合;
C.该反应反应前后气体分子物质的量减小,反应进行过程中容器内压强减小,容器内压强保持不变说明反应达到平衡状态,选项C符合;
D.N2的消耗速率等于H2的消耗速率,说明反应没有达到平衡状态,选项D不符合;
E.气体平均摩尔质量= 混合气体总质量÷总物质的量 ,反应体系中物质的质量始终不变,该反应反应前后气体分子物质的量减小,反应进行过程中气体的平均相对分子质量增大,容器中气体的平均相对分子质量不随时间而变化能说明反应达到平衡状态,选项E符合;
F.混合气体是无色混合气体,混合气体的颜色保持不变不能说明反应达到平衡状态,选项F不符合;
故答案为:A、C、E;
(3)实验1中以υ(NH3)表示的反应速率= ![]() =
=  =0.05mol/(Lmin);根据表中数据,实验2中反应物浓度比实验1小,实验2的温度比实验1高,实验2的速率比实验1快的原因是:实验2的温度比实验1高,故答案为:实验2温度高于实验1;
=0.05mol/(Lmin);根据表中数据,实验2中反应物浓度比实验1小,实验2的温度比实验1高,实验2的速率比实验1快的原因是:实验2的温度比实验1高,故答案为:实验2温度高于实验1;
(4)合成氨的反应为,N2+3H2![]() 2NH3。原电池中负极是物质失电子发生氧化反应,正极是物质得到电子发生还原反应,所以正极上发生反应的物质是N2,得到电子与氢离子结合生成氨气;电极反应式为:N2+6e-+6H+=2NH3,故答案为:N2+6e-+6H+=2NH3 。
2NH3。原电池中负极是物质失电子发生氧化反应,正极是物质得到电子发生还原反应,所以正极上发生反应的物质是N2,得到电子与氢离子结合生成氨气;电极反应式为:N2+6e-+6H+=2NH3,故答案为:N2+6e-+6H+=2NH3 。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
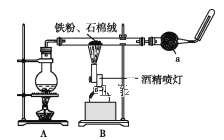

(1)已知该实验反应的反应方程式为:__Fe+__H2O![]() __Fe3O4+__H2(请配平)。
__Fe3O4+__H2(请配平)。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用图中__(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.448L,则铁粉的转化率为___。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②___ | Ⅲ.反应后的溶液中阳离子___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为___色 | ①___ ②Fe2++2OH—=Fe(OH)2↓ ③4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) →Fe(s)+CO2(g)-Q,已知1100℃时,K=0.263
(1)写出该反应的平衡常数表达式____。温度升高,化学平衡移动后达到新的平衡,高炉中CO2和CO的体积比值___,平衡常数K值___(以上选填“增大”、“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0025mol/L、c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态___(选填“是”或“否”),此时,化学反应速率是v正___v逆(选填“大于”、“小于”或“等于”),其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中:互为同分异构体的是___,互为同系物的是__,属于同一种物质的是___。
A.CH3CH2CH3、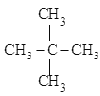 B.CH3-CH=CH-CH3、CH2=CH-CH2-CH3 C.CH2=CH-CH3、C2H4 D.
B.CH3-CH=CH-CH3、CH2=CH-CH2-CH3 C.CH2=CH-CH3、C2H4 D.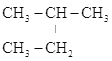 、
、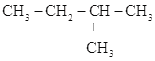 E.CH3CH2CH2COOH、CH3COOCH2CH3
E.CH3CH2CH2COOH、CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂又不是还原剂的是( )
A.C+H2O═CO+H2
B.2Na2O2+2H2O═2NaOH+O2↑
C.2Na+2H2O═2NaOH+H2↑
D.2F2+2H2O═4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式并用双线桥法表示电子转移的方向和数目:______________。
(2)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:________。
(3)工业上制漂白粉的化学方程式为____________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是_________。
(4)KAl(SO4)2·12H2O因其溶于水生成_____(化学式)可以吸附杂质,从而达到净水作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将28L HCl气体溶液在水中配成250mL盐酸溶液
(1)求所得盐酸的物质的量浓度;
(2)若取此溶液50mL再稀释成1L溶液,求稀释后盐酸的物质的量浓度;
(3)若用KMnO4氧化该盐酸溶液制氯气,反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,
若产生的Cl2在标准状况下的体积为672mL,则被氧化的HCl的物质的量.(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
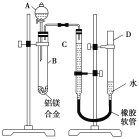
(1)A中试剂为_________________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是__________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂。上述操作的顺序是__________________ (填序号);记录C的液面位置时,除平视外,还应_________________。
(4)B中发生反应的化学方程式为___________________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是
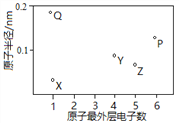
A. X与Q形成的化合物是离子化合物
B. X与Z的原子均含有1个未成对电子
C. Y与P形成的化合物YP2的分子空间构型是直线形
D. Q单质含有金属键,有自由移动的电子,因此可以导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com