
【题目】在下列反应中,水既不是氧化剂又不是还原剂的是( )
A.C+H2O═CO+H2
B.2Na2O2+2H2O═2NaOH+O2↑
C.2Na+2H2O═2NaOH+H2↑
D.2F2+2H2O═4HF+O2
【答案】B
【解析】
在氧化还原反应中,若水既不是氧化剂又不是还原剂,则水中H、O元素的化合价在反应前后不发生变化,据此判断。
A.C+H2O![]() CO+H2的反应中,H元素的化合价降低,水是氧化剂,碳元素化合价升高,碳是还原剂,A选项不符合题意;
CO+H2的反应中,H元素的化合价降低,水是氧化剂,碳元素化合价升高,碳是还原剂,A选项不符合题意;
B.过氧化钠与水的反应中,过氧化钠中O元素的化合价既升高又降低,过氧化钠既是氧化剂又是还原剂,水中元素的化合价均不变,既不是氧化剂也不是还原剂,B选项符合题意;
C.Na与水的反应中,Na元素的化合价升高,水中H元素的化合价降低,则水作氧化剂,钠是还原剂,C选项不符合题意;
D.单质氟与水的反应中,F元素的化合价降低,水中O元素的化合价升高,则水作还原剂,单质氟作氧化剂,D选项不符合题意;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )
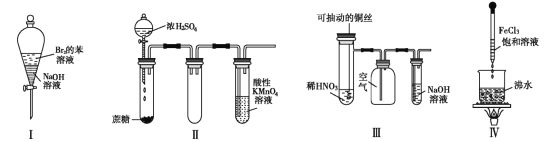
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为_________,碳原子和氧原子的个数比为________ ,该混合气体的摩尔质量为__________ 。
(2)12.4g含Na2X中含Na+0.4mol,则Na2X的摩尔质量是________ ,X的相对原子质量是____________。
(3)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L人造空气的质量是4.8g,其中氧气和氦气的分子数之比是_____________,氧气的质量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)如图所示物质的有关结构,请回答:
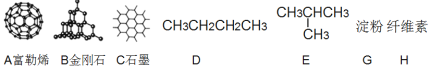
①A、B、C三者的关系为_________(填写序号)。
a.同分异构体b.同素异形体c.同一种物质d.同位素
②固态时,A属于__________晶体(填“离子”、“原子”或“分子”)。
③有同学认为D、E互为同分异构体而G、H两者并不是同分异构体的关系。这句话正确吗?答:__________(填写“正确”或“不正确”)
④有机物E用系统命名法命名的名称是__________。
(2)已知下列7种物质:a.P4(白磷) b.SiO2 c.NH4Cl d.NaOH e.NaCl f.干冰 g.金刚石,固态时它们都为晶体,回答下列问题:(填写序号)
①晶体中既有离子键又有共价键的是__________
②熔化时只需要破坏共价键的是__________
③熔点最高的晶体是__________,沸点最低的晶体是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溴苯乙烯(![]() )与丙烯(CH2=CH-CH3)发生聚合反应的产物是一种高分子阻燃剂,具有低毒、热稳定好等优点。
)与丙烯(CH2=CH-CH3)发生聚合反应的产物是一种高分子阻燃剂,具有低毒、热稳定好等优点。
完成下列各小题:
(1)写出该产物的结构简式:___。
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制中间体![]() 。写出该两步反应所需的试剂及条件____、____。
。写出该两步反应所需的试剂及条件____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表,完成下列问题。
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表,完成下列问题。
t/℃ | 25 | 125 | 225 | … |
K | 4.1×105 | K1 | K2 | … |
(1)该反应的化学平衡常数表达式为K=________;K1______K2(填“>”“<”或“=”);若增大压强使平衡向正反应方向移动,则平衡常数_________(填“变”或“不变”)。
(2)判断该反应达到化学平衡状态的依据是____________(填序号):
A.2υH2(正)= 3υNH3(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.N2的消耗速率等于H2的消耗速率
E.容器中气体的平均相对分子质量不随时间而变化 F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
N2 | H2 | NH3 | |||
1 | 650 | 2 | 4 | 0.9 | 9 |
2 | 900 | 1 | 2 | 0.3 | 0.01 |
实验1中以υ(NH3)表示的反应速率为______,实验2的速率比实验1快的原因是____________;
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图)。则其正极的电极反应为_____________。
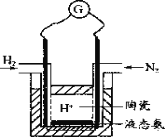
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答问题。
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因_________;农业上用石膏降低其碱性的反应原理____________。
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-向水中加NaHSO4固体,水的电离平向________移动,且所得溶液显_____性。
H3O++OH-向水中加NaHSO4固体,水的电离平向________移动,且所得溶液显_____性。
(3)若取 pH、体积均相等的NaOH和氨水分别加水稀释 m倍、n稀释后pH仍相等,则 m______n(填“>”“<”或“=”);
(4)常温下,在pH=6的CH3COOH与CH3COONa 的混合溶液中水电离出来的c(OH-)=_________;
(5)在如图坐标纸上画出用0.1000mol/LNaOH滴定20.00mL0.1000mol/LHCl的滴定曲线示意图。
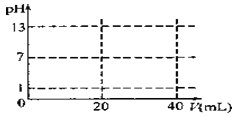 ______
______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下: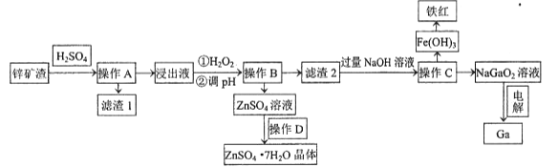
已知:①镓在元素周期表中位于第四周期第ⅢA族,化学性质与铝相似。
②lg2=0.3 lg3=0.48。
③部分物质的Ksp如下表所示。
物质 | Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有__________________(写出两条)。滤渣1的主要成分是硫酸铅及_________________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)______________________ 。
(3)室温条件下,若浸出液中各阳离子的浓度均为0.01mo/L,当溶液中某种离子浓度小于1×10-5mol/L时即认为该离子已完全除去,则pH应调节的范围为___________________。
(4)操作D包括:_______________过滤、洗涤、干燥。
(5)电解法制备金属镓。用惰性电极电解NaGaO2溶液即可制得金属镓,写出阴极电极反应式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的X和Y两种微粒,化学性质一定相似的是
A. 结构示意图:X为![]() ,Y为
,Y为 ![]()
B. X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2
C. X原子的2p能级上有3个电子,Y原子的3p能级上有3个电子
D. X原子核外M层上仅有2个电子,Y原子核外N层上仅有2个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com