
【题目】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下: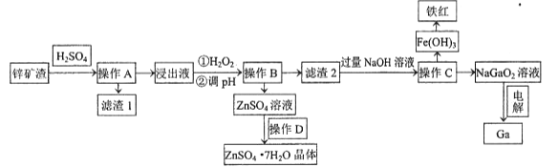
已知:①镓在元素周期表中位于第四周期第ⅢA族,化学性质与铝相似。
②lg2=0.3 lg3=0.48。
③部分物质的Ksp如下表所示。
物质 | Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有__________________(写出两条)。滤渣1的主要成分是硫酸铅及_________________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)______________________ 。
(3)室温条件下,若浸出液中各阳离子的浓度均为0.01mo/L,当溶液中某种离子浓度小于1×10-5mol/L时即认为该离子已完全除去,则pH应调节的范围为___________________。
(4)操作D包括:_______________过滤、洗涤、干燥。
(5)电解法制备金属镓。用惰性电极电解NaGaO2溶液即可制得金属镓,写出阴极电极反应式________________________。
【答案】升高温度、粉碎、搅拌等 SiO2 2Fe2++H2O2+2H+=2Fe3++2H2O 5.48<pH<6.6 蒸发浓缩、冷却结晶 GaO2-+2H2O+3e-=Ga+4OH-
【解析】
某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,加入硫酸,经过滤,得到滤渣Ⅰ为SiO2、PbSO4,浸出液含有Zn、Fe、Ga的离子,加入过氧化氢,可氧化亚铁离子生成铁离子,调节溶液pH生成Fe(OH)3、Ga(OH)3沉淀,滤液含有硫酸锌,经蒸发浓缩、冷却结晶可得到硫酸锌晶体,滤渣2含有Fe(OH)3、Ga(OH)3,加入过量的氢氧化钠,可生成NaGaO2溶液,过滤得到有Fe(OH)3,分解可生成氧化铁,电解NaGaO2溶液,可制备Ga,以此解答该题。
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有将矿物质粉碎、升高温度、搅拌等;由以上分析可知滤渣1为SiO2、PbSO4;
(2)在滤液中加入H2O2的目的是氧化Fe2+,调节溶液pH沉淀Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)调pH的目的是使Fe3+、Ga3+沉淀完全而Zn2+不沉淀,Ga(OH)3完全沉淀时,c(OH-)=![]() mol/L=3×10-9mol/L,则此时溶液的pH=5.48;如生成Zn(OH)2,则c(OH-)=
mol/L=3×10-9mol/L,则此时溶液的pH=5.48;如生成Zn(OH)2,则c(OH-)=![]() mol/L=4×10-8mol/L,则此时溶液的pH=6.6,故应调节pH范围为5.48<pH<6.6;
mol/L=4×10-8mol/L,则此时溶液的pH=6.6,故应调节pH范围为5.48<pH<6.6;
(4)操作D得到晶体,涉及操作为:蒸发浓缩,冷却结晶过滤、洗涤、干燥;
(5)①阴极上GaO2-发生还原反应生成Ga,电极方程式为GaO2-+2H2O+3e-=Ga+4OH-。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,将4molNH3和4molO2混合于固定容积为2L的密闭容器中,发生反应:4NH3(g)+5O2(g)=4X(g)+6H2O(g)。2min后该反应达到平衡,生成3molH2O。则:
(1)X的化学式为___。
(2)O2的转化率为___(O2转化率=已反应的O2的量/O2的总量×100%)。
(3)0~2min内,v(NH3)=___mol·L-1·min-1。
(4)燃料电池是一种高效、环境友好型发电装置。一种燃料电池的电解质溶液为NaOH溶液,负极通入NH3,正极通入空气,产物对环境无污染,则负极的电极反应式为___,电路中每通过1mol电子,消耗标准状况下的空气___(假设空气中O2的含量为20%)L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂又不是还原剂的是( )
A.C+H2O═CO+H2
B.2Na2O2+2H2O═2NaOH+O2↑
C.2Na+2H2O═2NaOH+H2↑
D.2F2+2H2O═4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将28L HCl气体溶液在水中配成250mL盐酸溶液
(1)求所得盐酸的物质的量浓度;
(2)若取此溶液50mL再稀释成1L溶液,求稀释后盐酸的物质的量浓度;
(3)若用KMnO4氧化该盐酸溶液制氯气,反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,
若产生的Cl2在标准状况下的体积为672mL,则被氧化的HCl的物质的量.(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 17 g H2O2与17 g H2S所含的电子数均为9NA
B. 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C. 0.1 mol Cl2通入适量水中,转移电子数为0.2NA
D. 2 L pH =3的醋酸与足量的锌反应,产生H2分子数为10-3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
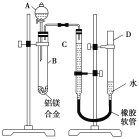
(1)A中试剂为_________________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是__________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂。上述操作的顺序是__________________ (填序号);记录C的液面位置时,除平视外,还应_________________。
(4)B中发生反应的化学方程式为___________________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)为原料生产Cr2O3的流程如下:
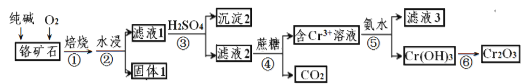
(1)Cr2O3在焙烧时生成Na2CrO4,写出第①步发生的所有方程式_________。
(2)沉淀2的化学式为_______。
(3)步骤③中CrO42-转化成Cr2O72- ,写出其离子方程式_______,硫酸能否换成盐酸并说明其理由______。
(4)滤液3中主要溶质的化学式为____________。
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示,则B点时铬的氧化物化学式为_______。
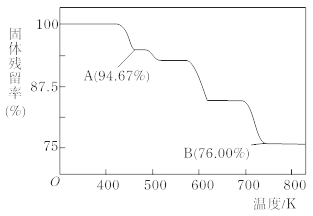
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面对SO2和CO2的描述正确的是
A. SO2为原子晶体,CO2为分子晶体
B. 中心原子采取的杂化方式:SO2为sp2杂化,CO2为sp杂化
C. 都是直线形结构
D. S原子和C原子上都没有孤电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )
X气体 | Y试剂 | Z试剂 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 饱和食盐水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com