
【题目】某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )
X气体 | Y试剂 | Z试剂 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 饱和食盐水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下: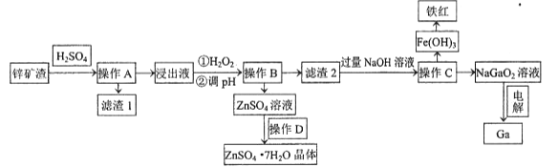
已知:①镓在元素周期表中位于第四周期第ⅢA族,化学性质与铝相似。
②lg2=0.3 lg3=0.48。
③部分物质的Ksp如下表所示。
物质 | Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有__________________(写出两条)。滤渣1的主要成分是硫酸铅及_________________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)______________________ 。
(3)室温条件下,若浸出液中各阳离子的浓度均为0.01mo/L,当溶液中某种离子浓度小于1×10-5mol/L时即认为该离子已完全除去,则pH应调节的范围为___________________。
(4)操作D包括:_______________过滤、洗涤、干燥。
(5)电解法制备金属镓。用惰性电极电解NaGaO2溶液即可制得金属镓,写出阴极电极反应式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的X和Y两种微粒,化学性质一定相似的是
A. 结构示意图:X为![]() ,Y为
,Y为 ![]()
B. X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2
C. X原子的2p能级上有3个电子,Y原子的3p能级上有3个电子
D. X原子核外M层上仅有2个电子,Y原子核外N层上仅有2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质结构揭示物质构成的奥秘,请回答以下问题:
(1)元素A含有8个质子,10个中子的核素,用核素符号表示为______。元素B被科学家称“防癌之王”,与元素A同主族位于第四周期,元素B的名称为______,A和B的氢化物,沸点较高的是_____(填化学式)。
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为______。
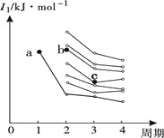
(3)如图是前四周期主族元素第一电离能梯度图,图中a点对应的元素为氢,则b点对应元素的未成对电子数为______,c点对应元素基态原子价电子排布式为_______。
(4)FeC13晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因是____。
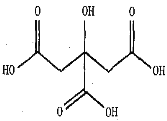
(5)水果中含有不同的果酸,其中柠檬、柑橘等水果中含有柠檬酸,柠檬酸的结构如下图。柠檬酸的晶体类型为_____,碳原子的杂化轨道类型为_____;柠檬酸晶体中含有的作用力有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种物质:

⑴ 乙中含有的官能团的名称为_______。
⑵由甲转化为乙需经下列过程(已略去各步反应的部分产物,下同):
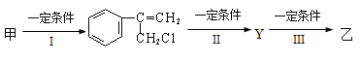
反应Ⅰ类型_______;反应II的条件是______;反应III的化学方程式为_______(不需注明反应条件)。
⑶由甲出发合成丙的路线之一如下:
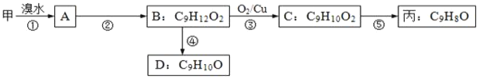
①下列物质不能与B反应的是______(选填序号)。
a.金属钠 b.FeCl3溶液 c.Na2CO3溶液 d.HBr溶液
②C的结构简式为 _______;第⑤步反应类型_________;
③任写一种能同时满足下列条件的D的同分异构体的结构简式_________。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
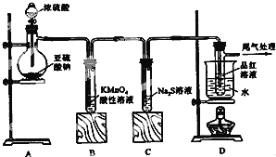
下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是___ ,发生反应的化学方程式为___;
(2)实验过程中,装置B、C中发生的现象分别是___、___,这些现象分别说明SO2具有的性质是___和___;装置C中发生反应的离子方程式为___;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象___;
(4)尾气可采用___溶液吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B. 将体积增大为原来的2倍,再次达到平衡时,气体的密度变大
C. 因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以是△H<0
D. 保持容器压强不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是合成赖氨酸、环己酮、苯酚等的重要原料,也常用作石油萃取剂及高辛烷值汽油稳定剂。
制备环己烯的反应原理:主反应![]() ;副反应
;副反应![]()
制备环己烯的实验装置图如下:(夹持装置及加热装置已省略)
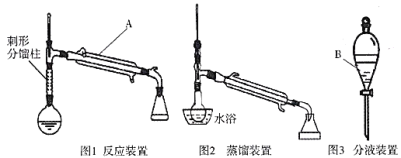
相应的实验流程如下图所示:

相关物质沸点、密度、溶解性如下:
沸点/℃ | 密度/( | 水中溶解性 | |
环己醇 | 161 | 0.962 4 | 可溶于水 |
环己烯 | 83 | 0.811 | 不溶于水 |
85% | 1.69 | 易溶于水 | |
环己烯与水形成的共沸物(含水10%) | 70.8 | ||
环己醇与水形成的共沸物(含水80%) | 97.8 |
回答下列问题:
(1)实验中不用浓硫酸,而用85%![]() 溶液,说明理由________________(写出一条即可)。
溶液,说明理由________________(写出一条即可)。
(2)向粗产物环己烯中加入食盐使水层饱和的目的是_____________;水浴蒸馏前加入无水氯化钙的目的是___________________________.
(3)仪器A、B的名称分别是________________________。
(4)蒸馏提纯时用到水浴加热的方法,其优点是______________(写出两条即可)。
(5)文献资料要求本实验的反应温度应不超过90℃,其原因是_____________________。
(6)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com