
【题目】环己烯是合成赖氨酸、环己酮、苯酚等的重要原料,也常用作石油萃取剂及高辛烷值汽油稳定剂。
制备环己烯的反应原理:主反应![]() ;副反应
;副反应![]()
制备环己烯的实验装置图如下:(夹持装置及加热装置已省略)
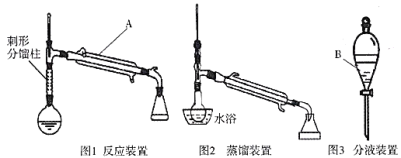
相应的实验流程如下图所示:

相关物质沸点、密度、溶解性如下:
沸点/℃ | 密度/( | 水中溶解性 | |
环己醇 | 161 | 0.962 4 | 可溶于水 |
环己烯 | 83 | 0.811 | 不溶于水 |
85% | 1.69 | 易溶于水 | |
环己烯与水形成的共沸物(含水10%) | 70.8 | ||
环己醇与水形成的共沸物(含水80%) | 97.8 |
回答下列问题:
(1)实验中不用浓硫酸,而用85%![]() 溶液,说明理由________________(写出一条即可)。
溶液,说明理由________________(写出一条即可)。
(2)向粗产物环己烯中加入食盐使水层饱和的目的是_____________;水浴蒸馏前加入无水氯化钙的目的是___________________________.
(3)仪器A、B的名称分别是________________________。
(4)蒸馏提纯时用到水浴加热的方法,其优点是______________(写出两条即可)。
(5)文献资料要求本实验的反应温度应不超过90℃,其原因是_____________________。
(6)
【答案】浓硫酸具有强氧化性,会氧化部分原料,导致产率降低(其他合理答案也可) 降低环己烯的溶解度,加快有机层与无机层的分层 除去残留在有机层中的水,防止蒸馏产品形成环己烯与水的共沸物,提高所得产品纯度 直形冷凝管、分液漏斗 受热均匀、易控制加热温度(其他合理答案也可) 环己醇能与水形成共沸物,且该共沸物的沸点为97.8℃,若加热温度超过90℃会造成原料环己醇的大量流失,从而降低产率 34.9
【解析】
环己醇在85%磷酸溶液中反应生成环己烯和水,副反应为环己醚,将环己醇、85%磷酸和沸石加入到烧瓶中,安装好一起加热、控制反应温度小于90℃,利于生成主反应反应,避免环己醇与水形成的共沸物,减少环己醇损失,得到粗产品加入食盐至饱和,利于分离出环己烯,再用无水氯化钙干燥,避免环己烯与水形成共沸物,用水浴蒸馏。
(1)实验中不用浓硫酸,而用85%![]() 溶液,
溶液,![]() 、
、![]() 易被浓硫酸氧化,说明理由浓硫酸具有强氧化性,会氧化部分原料,导致产率降低;故答案为:浓硫酸具有强氧化性,会氧化部分原料,导致产率降低(其他合理答案也可)。
易被浓硫酸氧化,说明理由浓硫酸具有强氧化性,会氧化部分原料,导致产率降低;故答案为:浓硫酸具有强氧化性,会氧化部分原料,导致产率降低(其他合理答案也可)。
(2)向粗产物环己烯中加入食盐使水层饱和的目的是降低环己烯的溶解度,加快有机层与无机层的分层;水浴蒸馏前加入无水氯化钙,根据题中信息环己烯与水易形成共沸物,因此无水氯化钙吸收残留在有机层中的水,防止蒸馏产品形成环己烯与水的共沸物,提高所得产品纯度;故答案为:降低环己烯的溶解度,加快有机层与无机层的分层;除去残留在有机层中的水,防止蒸馏产品形成环己烯与水的共沸物,提高所得产品纯度。
(3)根据题中得出仪器A、B的名称分别是直形冷凝管、分液漏斗;故答案为:直形冷凝管、分液漏斗。
(4)蒸馏提纯时用到水浴加热的方法,其优点是受热均匀、易控制加热温度;故答案为:受热均匀、易控制加热温度(其他合理答案也可)。
(5)文献资料要求本实验的反应温度应不超过90℃,根据题中信息环己醇与水形成的共沸物(含水80%)的沸点是97.8℃,温度高于90℃,大量环己醇就会被蒸馏除去,造成环己醇利用率低;故答案为:环己醇能与水形成共沸物,且该共沸物的沸点为97.8℃,若加热温度超过90℃会造成原料环己醇的大量流失,从而降低产率。
(6)![]() ,根据方程式理论上得到环己烯的质量为
,根据方程式理论上得到环己烯的质量为![]() ,环己烯的产率为
,环己烯的产率为![]() ;故答案为:34.9。
;故答案为:34.9。


科目:高中化学 来源: 题型:
【题目】某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )
X气体 | Y试剂 | Z试剂 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 饱和食盐水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知反应:R-CH=CH-O-R′(烃基烯基醚) ![]() R-CH2CHO + R′OH
R-CH2CHO + R′OH
烃基烯基醚A的相对分子质量Mr(A)=162,水解产物B的相对分子质量Mr(B)=46。与A相关的化学反应如下,请回答下列问题:
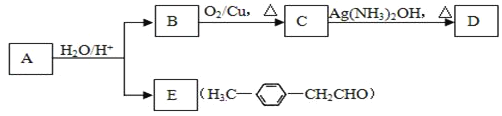
(1)A的结构简式为______________________,该分子中有_________种环境的氢原子。
(2)B的名称是__________,写出B→C反应的化学方程式:________________________。
(3)写出C → D反应的化学方程式:_______________________________________。
(4)写出同时符合下列条件的E的所有同分异构体的结构简式:①属于芳香醛 ②苯环上有两种不同环境的氢原子_________________________。
II.已知: ![]() +ClCH2CH3
+ClCH2CH3 +HCl
+HCl
(5)请写出以![]() 、B和苯作为原料,合成
、B和苯作为原料,合成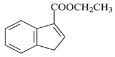 的流程图(注:无机试剂任用)____________________。
的流程图(注:无机试剂任用)____________________。![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氯丙嗪也叫冬眠灵,是第一个抗精神病药,开创了药物治疗精神疾病的历史,某研究小组利用下列途径合成盐酸氯丙嗪。

已知: 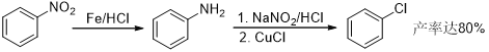
请回答:
(1) B中含有官能团名称为__________________;
(2) 下列说法不正确的是____________;
A. 化合物B可以发生加成反应
B. 化合物D在一定条件下既可与酸反应,又可以与碱反应
C. 合成路线中属于取代反应的为(1) (3) (4) (6)
D. 反应(7)是为了提高氯丙嗪的水溶性
(3) 写出E→F的化学反应方程式________________________________________________。
(4) 该研究小组在实验中发现,苯环上直接用Cl2取代的产率一般不到10%,请你设计合理步骤,利用甲苯为原料,合成化合物C________。(注:苯甲酸的苯环上发生取代反应时,取代主要发生在羧基的间位)
(5) 请写出符合下列条件的所有E的同分异构体________。
a. 分子中含有一个萘环![]() ,且为萘的邻位二取代物(邻位不包括
,且为萘的邻位二取代物(邻位不包括 );
);
b. 分子中有一个五元环;
c. 1H-NMR显示分子中有8种氢。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质普图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体
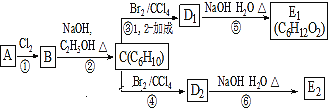
(1)A中的碳原子是否都处于同一平面?__________(填“是”或者“不是”)。
(2)反应②的化学方程式为__________。
(3)C的化学名称是__________,其反式加聚产物的结构简式是__________。
(4)E2在Cu催化作用下氧化的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,用NaOH调节0.10mol/LH2C2O4溶液的pH,假设不同pH下均有c(H2C2O4)+c(HC2O4—)+c(C2O42-)=0.10mol/L。使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如下图。下列有关分析正确的是

A. 曲线a代表H2C2O4浓度随pH的变化
B. pH从4到6时主要发生的反应离子方程式为2OH-+H2C2O4====2H2O+C2O42-
C. 在曲线a、c交界点有:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
D. 当溶液pH=7时:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是

A.①代表滴加NaHSO4溶液的变化曲线
B.d点,溶液中大量存在的离子是Na+、SO42–
C.c点,两溶液中含有相同物质的量的OH–
D.d点导电性小于b点,原因可能是发生化学反应导致Na+、SO42-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
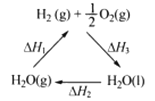
下列说法不正确的是
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com