
【题目】20℃时,用NaOH调节0.10mol/LH2C2O4溶液的pH,假设不同pH下均有c(H2C2O4)+c(HC2O4—)+c(C2O42-)=0.10mol/L。使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如下图。下列有关分析正确的是

A. 曲线a代表H2C2O4浓度随pH的变化
B. pH从4到6时主要发生的反应离子方程式为2OH-+H2C2O4====2H2O+C2O42-
C. 在曲线a、c交界点有:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
D. 当溶液pH=7时:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H2C2O4)
【答案】D
【解析】
b曲线代表H2C2O4浓度,a曲线代表HC2O4—浓度,c曲线代表C2O42-浓度。
A、曲线a代表HC2O4—浓度随pH的变化,浓度先变大,再变小,故A错误;
B、pH从4到6时主要发生的反应离子方程式为OH-+HC2O4—=H2O+C2O42-,故B错误;
C、由图中信息可知,在曲线a、c交界点,c(H2C2O4)非常小,c(C2O42-)=c(HC2O4-),溶液呈酸性,但氢离子浓度很小,c(H+)+c(H2C2O4)<c(OH-)+c(C2O42-),故C错误;
D、当溶液pH=7时,溶液呈中性。由图可知,该溶液为Na2C2O4和NaHC2O4的混合溶液,且溶质以Na2C2O4为主,只含很少量的NaHC2O4,C2O42-的一级水解远远大于其二级水解,因此该溶液中相关粒子浓度的大小关系为:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H2C2O4),故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 乙烯与苯都能使溴水褪色,但褪色原理不同
B. 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气 5mol
C. 溴水遇到乙醛溶液出现褪色现象,是因为发生了氧化反应
D. ![]() 与
与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[Cux(OH)yClz.mH2O]是重要的农药、医药中间体,还可用作木材防腐剂、饲料添加剂等。研究小组在实验室用某厂废铜渣(主要成分Cu、CuO,含少量Fe3O4、Ni、A12O3)制备碱式氯化铜的流程如下:
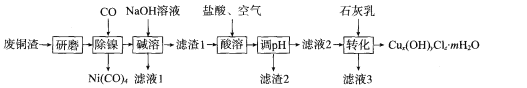
回答下列问题:
(l)“研磨”的目的为___ 。
(2)“碱溶”的目的为 __ 。
(3)“酸溶”时生成Fe3+反应的离子方程式为 ___;生成的Fe3+对Cu发生的氧化反应的催化原理如图所示。N的化学式为____。
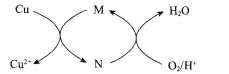
(4)“酸溶”时温度不能过高的理由为____。
(5)若滤液2中c(Fe3+)=4×10-8 mol/L,pH=4,则Ksp[Fe(OH)3]=____。
(6)为测定Cux (OH)yClz.mH2O的组成,进行如下操作:取样品2.232 g,用适量酸溶解后配成100 mL溶液;取25. 00 mL溶液加入足量AgNO3溶液,生成0.3444 g沉淀;另取25. 00 mL溶液,用0.1600 mol.L-1的EDTA标准液滴定Cu2+(Cu2+与EDTA以物质的量之比1:1反应),滴定至终点时消耗标准液体积为30. 00 mL。
①溶解样品所用酸的化学式为 ___。
②该样品的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硫与铁反应生成硫化铁
B.硫化氢中硫元素只表现氧化性
C.二氧化硫具有漂白性,可以使酸碱指示剂褪色
D.浓硫酸可以使小木条变黑,体现了浓硫酸的脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题。
(1)基态氮原子的价电子排布图为________________。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ 键的数目为_____________。
②与CNO—互为等电子体的分子为_____________。(任写一种,填化学式)
(3)往CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子,已知NF3和NH3的空间构型都是三角锥型,但NF3不易与Cu2+形成配合离子,其原因是_______。
(4)分子中的大 π键可用符合 πmn 表示,其中m表示形成大 π 键的原子数,n表示参与形成大 π 键的电子数(如苯分子中的大 π键可表示为π66)。则NO3-中的大 π键应表示为________________。
(5)多硼酸根的结构之一为链状(如图),其化学式为____________。

(6)氮化硼晶体有多种结构,其中立方氮化硼具有金刚石的结构(如图)。若晶胞边长为a nm,晶胞中N原子位于B原子所形成的正四面体的体心,则B—N键的键长为____nm,这种氮化硼晶体的密度为______g/cm3 。(用含有a和NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁样品中含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上述流程,回答以下问题:
(1)操作I是配制一定物质的量浓度的溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_________、__________(填仪器名称)。
(2)下列操作可能使所配溶液浓度偏小的是___________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出上图中滴加氯水后所发生反应的离子方程式____________________。
(4)检验沉淀是否已经洗涤干净的操作是____________。
(5)样品中铁元素的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,盛放海带的仪器名称是______________。
(2)步骤③的实验操作名称是_________,步骤⑥的目的是从含碘苯溶液中分离出碘单质和回收苯,该步骤的实验操作名称是_______________。
(3)步骤④反应的离子方程式是______________________________。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为由石油制取汽油的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是________________、__________________
(2)A仪器的名称是________,B仪器的名称是________。
(3)实验时 A 中除加入石油外,还需加入少量__________,其作用是__________________。
(4)收集完汽油后,是先撤酒精灯还是先停冷凝水?
______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是

A. 17g羟基(-OH)所含电子总数为9NA
B. 18gD2O中含有的原子数为3NA
C. 标准状况下,22.4LCHCl3中所含分子数为NA
D. 32g S8单质(结构如图)中含有的S-S键个数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com