
【题目】某烃类化合物A的质普图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体
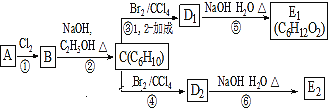
(1)A中的碳原子是否都处于同一平面?__________(填“是”或者“不是”)。
(2)反应②的化学方程式为__________。
(3)C的化学名称是__________,其反式加聚产物的结构简式是__________。
(4)E2在Cu催化作用下氧化的化学方程式为__________。
【答案】是 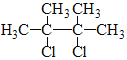 +2NaOH
+2NaOH![]()
![]() +2NaCl+2H2O 2,3-二甲基-1,3-丁二烯
+2NaCl+2H2O 2,3-二甲基-1,3-丁二烯 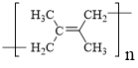

【解析】
某烃类化合物A的质普图表明其相对分子质量为84,84÷12=7,去1个碳原子,得12个氢原子,红外光谱表明分子中含有碳碳双键,因为分子式为C6H12,核磁共振氢谱表明分子中只有一种类型的氢,说明A为(CH3)2C=C(CH3)2。A与氯气发生加成反应生成B( ),B发生消去反应生成
),B发生消去反应生成![]() ,1mol
,1mol ![]() 与1mol溴单质发生加成1,2-加成或1,4-加成,得到的产物再发生水解反应得到醇。据此解答。
与1mol溴单质发生加成1,2-加成或1,4-加成,得到的产物再发生水解反应得到醇。据此解答。
(1)A为(CH3)2C=C(CH3)2,根据乙烯中六个原子在同一平面内,得到A中的碳原子都处于同一平面;故答案为:是。
(2)A与氯气发生加成反应生成 ,
, 在氢氧化钠乙醇加热条件下反应生成烯烃、氯化钠和水,因此②的化学方程式为
在氢氧化钠乙醇加热条件下反应生成烯烃、氯化钠和水,因此②的化学方程式为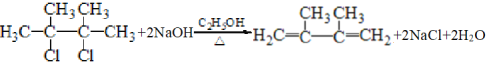 ;故答案为:
;故答案为: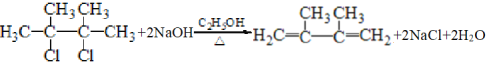 。
。
(3)C的结构简式为![]() ,其化学名称是2,3-二甲基-1,3-丁二烯;其反式加聚产物的结构简式是
,其化学名称是2,3-二甲基-1,3-丁二烯;其反式加聚产物的结构简式是 ;故答案为:2,3-二甲基-1,3-丁二烯;
;故答案为:2,3-二甲基-1,3-丁二烯; 。
。
(4)C到D2是发生1,4加成得到![]() ,D2水解生成
,D2水解生成![]() ,E2(
,E2(![]() )在Cu催化作用下氧化的化学方程式为
)在Cu催化作用下氧化的化学方程式为 ;故答案为:
;故答案为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:D为烃;E分子中碳元素与氢元素的质量之比6∶1,相对分子质量为44,其燃烧产物只有CO2和H2O。A的最简式与F相同,且能发生银镜反应,可由淀粉水解得到。
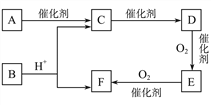
(1)A的结构简式为__________________。
(2)写出D→E的化学方程式:_______________________。
(3)下列说法正确的是____。
A.有机物F能使石蕊溶液变红
B.用新制的氢氧化铜无法区分有机物C、E、F的水溶液
C.等物质的量的C和D分别完全燃烧消耗氧气的量相等
D.可用饱和碳酸钠溶液除去有机物B中混有的少量C、F
E. B的同分异构体中能发生银镜反应的酯类共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是合成赖氨酸、环己酮、苯酚等的重要原料,也常用作石油萃取剂及高辛烷值汽油稳定剂。
制备环己烯的反应原理:主反应![]() ;副反应
;副反应![]()
制备环己烯的实验装置图如下:(夹持装置及加热装置已省略)
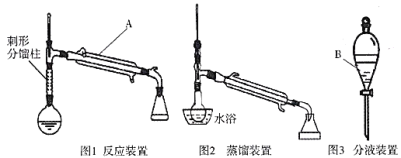
相应的实验流程如下图所示:

相关物质沸点、密度、溶解性如下:
沸点/℃ | 密度/( | 水中溶解性 | |
环己醇 | 161 | 0.962 4 | 可溶于水 |
环己烯 | 83 | 0.811 | 不溶于水 |
85% | 1.69 | 易溶于水 | |
环己烯与水形成的共沸物(含水10%) | 70.8 | ||
环己醇与水形成的共沸物(含水80%) | 97.8 |
回答下列问题:
(1)实验中不用浓硫酸,而用85%![]() 溶液,说明理由________________(写出一条即可)。
溶液,说明理由________________(写出一条即可)。
(2)向粗产物环己烯中加入食盐使水层饱和的目的是_____________;水浴蒸馏前加入无水氯化钙的目的是___________________________.
(3)仪器A、B的名称分别是________________________。
(4)蒸馏提纯时用到水浴加热的方法,其优点是______________(写出两条即可)。
(5)文献资料要求本实验的反应温度应不超过90℃,其原因是_____________________。
(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
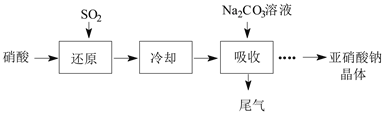
已知:Ⅰ.Na2CO3+NO+NO2=2NaNO2+CO2;Na2CO3+2NO2=NaNO2+NaNO3+CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___(填元素符号)。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___。
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___。
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00mL0.100mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL0.100mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度___(“偏大”、“偏小”或“无影响”),原因是___。
②通过计算,该样品中NaNO2的质量分数是___,可能含有的杂质有___(写出其中一种即可)。
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2+O2![]() 2SO3在密闭容器中进行。下列说法正确的是( )
2SO3在密闭容器中进行。下列说法正确的是( )
A.使用催化剂不能改变反应速率
B.达平衡时SO2与SO3的浓度相等
C.增大压强能加快反应速率
D.SO2与O2反应能完全转化为SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。已知:Cr3+![]() Cr(OH)3
Cr(OH)3![]() CrO2-。
CrO2-。
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式_______________________。
②用离子方程式表示溶液pH不能超过10的原因__________________________________。
③若处理后的废水中残留的c(Fe3+)=2×10-13 mol/L,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合成氢氧化物沉淀而除去。
①写出阴极的电极反应式__________________________。
②电解法中加入氯化钠的作用是______________________。
(3)某化学兴趣小组以含+6价铬和+2价锰的工业废水为试样,研究铁屑用量和pH对废水中铬、锰去除率的影响。
①取100mL废水于250 mL三角瓶中,调节pH到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图所示。则在pH一定时,废水中铁屑用量为____________时,锰、铬去除率最好。
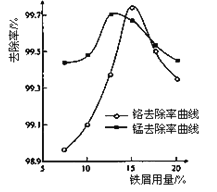
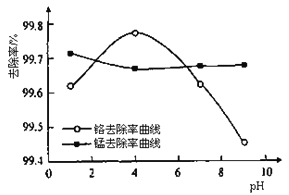
②取100mL废水于250 mL三角瓶中,加入规定量铁粉,调成不同的pH。得到pH对铬和锰去除率的影响如下图所示。则在铁屑用量一定时,废水pH=__________时锰、铬去除率最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应不属于置换反应而属于氧化还原反应的是( )
A.Fe2O3+3CO![]() 2Fe+3CO2B.Zn+H2SO4=ZnSO4+H2↑
2Fe+3CO2B.Zn+H2SO4=ZnSO4+H2↑
C.3Fe+4H2O(g)![]() Fe3O4+4H2D.4NH3+3O2
Fe3O4+4H2D.4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com