
����Ŀ�������������ж���������Σ���ܴ���˺�����ˮ������д��������ŷš���֪��Cr3+![]() Cr(OH)3
Cr(OH)3![]() CrO2-��
CrO2-��
(1)�ں�+6�۸��ķ�ˮ�м���һ���������������������ʹ+6�۸���ԭ��+3�۸����ٵ�����ҺpH��6��8֮�䣬ʹFe3+��Cr3+ת��ΪFe(OH)3��Cr(OH)3��������ȥ��
��д��Cr2O72-��FeSO4��Һ�����������·�Ӧ�����ӷ���ʽ_______________________��
�������ӷ���ʽ��ʾ��ҺpH���ܳ���10��ԭ��__________________________________��
����������ķ�ˮ�в�����c(Fe3+)=2��10��13 mol/L���������Cr3+��Ũ��Ϊ___________��(��֪��Ksp[Fe(OH)3]=4.0��10-38 Ksp[Cr(OH)3]=6.0��10-31)
(2)����+6�۸��ķ�ˮ��������ڣ������������������������Ȼ��ƽ��е�⡣���������ɵ�Fe2+��Cr2O72һ������Ӧ�����ɵ�Fe3+��Cr3+����������OHһ��ϳ����������������ȥ��
��д�������ĵ缫��Ӧʽ__________________________��
�ڵ�ⷨ�м����Ȼ��Ƶ�������______________________��
(3)ij��ѧ��ȤС���Ժ�+6�۸���+2���̵Ĺ�ҵ��ˮΪ�������о���м������pH�Է�ˮ�и�����ȥ���ʵ�Ӱ�졣
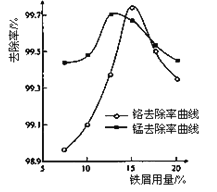
��ȡ100mL��ˮ��250 mL����ƿ�У�����pH���涨ֵ���ֱ���벻ͬ���ķ���м���õ���м�����Ը�����ȥ���ʵ�Ӱ������ͼ��ʾ������pHһ��ʱ����ˮ����м����Ϊ____________ʱ���̡���ȥ������á�
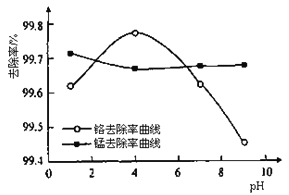
��ȡ100mL��ˮ��250 mL����ƿ�У�����涨�����ۣ����ɲ�ͬ��pH���õ�pH�Ը�����ȥ���ʵ�Ӱ������ͼ��ʾ��������м����һ��ʱ����ˮpH=__________ʱ�̡���ȥ������á�
���𰸡�Cr2O72++6Fe2++14H+=2Cr3++6Fe3++7H2O Cr(OH)3 +OH-=CrO2-+2H2O 3��10-6 mol/L 2H++2e-=H2����2H2O+2e-=H2��+2OH- ��ǿ��Һ������ 15% 4
��������
(1)��Cr2O72-��FeSO4��Һ�����������»ᷢ��������ԭ��Ӧ��
���������֪����pH����10��c(OH-)��10-4mol/Lʱ��Cr(OH)3ת���CrO2-��
(2)��������ˮ�е������ӷŵ�����������
��ˮ��������ʣ��������ܽϲ�Ȼ�����ǿ���������ǿˮ�ĵ����ԣ�
(3)����ͼ��֪�����������ӵ�ȥ���ʶ��ϴ�ʱ����Ӧ��pHֵ�Ͱٷ������Ǵ���ֵ��
(1)��Cr2O72-��FeSO4��Һ�����������»ᷢ��������ԭ��Ӧ������Cr3+��Fe3+��H2O�����ݵ����غ㡢����غ㼰ԭ���غ㣬�ɵ÷�Ӧ�����ӷ���ʽCr2O72++6Fe2++14H+=2Cr3++6Fe3++7H2O��
���������֪����pH����10��c(OH-)��10-4mol/Lʱ��Cr(OH)3ת���CrO2-������Cr(OH)3+OH-=CrO2-+2H2O��
(2)�ٽ���+6�۸��ķ�ˮ��������ڣ������������������������Ȼ��ƽ��е�⣬��������ʧ�������ɶ��������ӣ������������ӵõ��������������缫��ӦʽΪ��2H++2e-=H2����2H2O+2e-=H2��+2OH-��
��ˮ��������ʣ���������ˮ�ĵ���������С���Ȼ�����ǿ����ʣ���ˮ������ȫ���뵼����Һ��������Ũ��������������ǿ��Һ�����ԣ�
(3)�ٸ���ͼ1֪����������������ʱ�����ӵ�ȥ������������С������ˮ����м����Ϊ15%ʱ�̡���ȥ������ã�
�ڸ���ͼ2֪������Һ��pHֵ������ʱ�������ӵ�ȥ�����ȼ�С��������ȥ������������С����pH=4ʱ�̡���ȥ������á�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������{[CH3CH(OH)COO]2Fe��3H2O}����Է���������288��������������FeCO3��Ӧ�Ƶã���������ˮ�������������Ҵ�����һ�ֺܺõIJ�����������ˮ��Һ�ױ����������տɴٽ�������
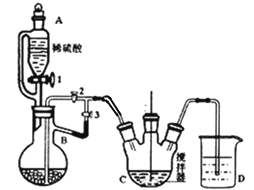
I���Ʊ�̼��������װ����ͼ��ʾ��
п�� NH4HCO3��Һ
��1������B��������________��
��2��ʵ��������£��رջ���2������1��3����������ϡ���ᷴӦһ��ʱ�䣬��Ŀ����____________________________��Ȼ��رջ���1���������IJ�����____________________���˺�Cװ����Һ���г������ɣ����д�������ð������C�з�����Ӧ�����ӷ���ʽΪ_____________________________________��
�����Ʊ�����������
��3������FeCO3�����������������Һ����75���½���ʹ֮��ַ�Ӧ���÷�Ӧ�ļ��ȷ�ʽΪ____________��Ϊ��ֹ�����������ʣ���������ϵ�л�Ӧ�����������ۡ���Ӧ������������Һ������������Ũ����_________�����ˡ�ϴ�ӡ�����������������塣�þ�����ʱӦע��_________________________��
III�������������崿�ȵIJ�����
��4��ijͬѧ����������(NH4)4Ce(SO4)4�ζ����ⶨ��Ʒ��Fe2+�ĺ�����������Ʒ���ȣ���Ӧ��Ce4+��ԭΪCe3+��������ȡ6.00g��Ʒ�����Ƴ�250.00mL��Һ��ȡ��25.00mL����Ũ��Ϊ0.10mol��L-1��(NH4)4Ce(SO4)4����Һ�ζ����յ㣬���ı�Һ20.00mL�����Ʒ��������������Ĵ���Ϊ________(������������ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������A������ͼ��������Է�������Ϊ84��������ױ��������к���̼̼˫�����˴Ź������ױ���������ֻ��һ�����͵��⡣����ͼ�У�D1��D2��Ϊͬ���칹�壬E1��E2��Ϊͬ���칹��
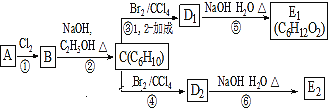
(1)A�е�̼ԭ���Ƿ���ͬһƽ��?__________(��ǡ����ߡ����ǡ�)��
(2)��Ӧ�ڵĻ�ѧ����ʽΪ__________��
(3)C�Ļ�ѧ������__________���䷴ʽ�Ӿ۲���Ľṹ��ʽ��__________��
(4)E2��Cu�������������Ļ�ѧ����ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
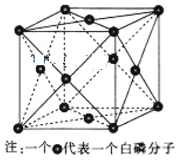
����Ŀ��CoP��FeS2��NiS2�����ʶԵ绯ѧ��������Ӧ�����õĴ����Ժ��ȶ��ԡ���ش��������⣺
(1)��̬Coԭ�Ӽ۲���ӵĵ����Ų�ͼ(�������ʽ)Ϊ________________����̬Pԭ�ӵĵ���ռ������ܼ��ĵ���������ͼΪ_______��
(2)PH3�ķе�_____(����ڡ����ڡ�)NH3��ԭ����______________��
(3)��ͼΪ����(P4)�ľ���ʾ��ͼ�������ı߳�Ϊa nm���谢���ӵ���������ֵΪNA���侧���ܶȵļ������ʽΪ______g��cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͬ��Ba(OH)2��Һ�У��ֱ�������ʵ���Ũ����ȵ�H2SO4��NaHSO4��Һ���䵼�������������Һ����仯��������ͼ��ʾ�����з�����ȷ����

A.�ٴ����μ�NaHSO4��Һ�ı仯����
B.d�㣬��Һ�д������ڵ�������Na+��SO42�C
C.c�㣬����Һ�к�����ͬ���ʵ�����OH�C
D.d�㵼����С��b�㣬ԭ������Ƿ�����ѧ��Ӧ����Na+��SO42-Ũ�ȼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˺������û�ѧ�ܣ�ȷ����ȫ���������������Ҫ��ֿ��ǻ�ѧ��Ӧ�ķ�Ӧ�ȣ�����ȡ��Ӧ��ʩ����ѧ��Ӧ�ķ�Ӧ��ͨ����ʵ����вⶨ��Ҳ�ɽ����������㡣
��1���������������Ȼ�ѧ����ʽ����a _____ b ����������������������������
H2��g��+![]() O2��g���TH2O ��l�� ��H1��a kJmol��1
O2��g���TH2O ��l�� ��H1��a kJmol��1
H2��g��+![]() O2��g���TH2O ��g�� ��H2��b kJmol��1
O2��g���TH2O ��g�� ��H2��b kJmol��1
��2����lmol��̬������ij�ֹ��ۼ���Ҫ���յ������м��ܣ����ֻ�ѧ�����������
��ѧ�� | H��H | N��H | N��N |
����/kJmol��1 | 436 | a | 945 |
��֪��ӦN2��g��+3H2��g����2NH3��g�� ��H��-93 kJmol��1���Ը��ݱ������м������ݼ���a=______________��
��3������ˮú���ϳɶ����ѣ�CH3OCH3����������Ӧ���£�
��2H2��g��+ CO��g���T CH3OH��g�� ��H1
��2CH3OH��g���T CH3OCH3��g��+ H2O��g�� ��H2
��3 H2��g��+3CO��g���T CO2��g�� + CH3OCH3��g�� ��H3
��Ӧ��Ϊ��ȡ�����ѵĵ�3����Ӧ��������H1����H2������H3ʱ������Ҫ����________��Ӧ����H��
��4���п�Ժ������ѧ�����о����Ŀ�����Ա���������״���Na-Fe3O4��HMCM-22 �ı��潫CO2ת��Ϊ�������������ͼ��
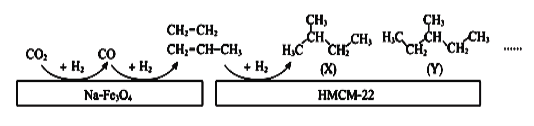
ͼ��CO2ת��ΪCO�ķ�ӦΪ�� CO2(g)+H2(g) = CO(g)+H2O(g) ��H= +41kJ/mol
��֪��2CO2(g) + 6H2(g) = C2H4(g) + 4H2O(g) ��H= -128kJ/mol
��ͼ��COת��ΪC2H4���Ȼ�ѧ����ʽ��______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����ȼú�����к��е�SO2��NOx���о�������������������������������ķ�����
��1����ȼú�м�������ʯ��ʯ������ʱ��SO2ת��ΪCaSO4�Ļ�ѧ����ʽ��__________��
��2��ѡ���Դ���ԭ����SCR�������������ڴ����������£�ѡȡ��ԭ���������е�NOx��������������NH3��ԭNO2�Ļ�ѧ����ʽ��_______________________________��
��3����NaClO��Һ��Ϊ���ռ�����һ�廯����������������������Һ��pH��5.5���������е�SO2��NOת��ΪSO42��NO3����Ϊ���ȷ�Ӧ��
����ͼ1�л��������ȷ�Ӧ���ķ�Ӧ�����е������仯ʾ��ͼ��_________
��NaClO��Һ����������NO�����ӷ���ʽ��________________________________��
��һ��ʱ���ڣ��¶ȶ������ѳ��ʵ�Ӱ��������ͼ2��SO2���ѳ��ʸ���NO�����ܵ�ԭ����____��д��1�ּ��ɣ���
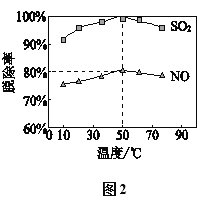
��������SO2��NO�������Ϊ3��1��50��ʱ���ѳ��ʼ�ͼ2���������Һ������ת�����ɵ�Cl��NO3�����ʵ���֮��Ϊ______________________��д��������ȣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʲ���ʹCH3COOH�ĵ���ƽ�������ƶ�����( )
A. CH3COONa����B. ����C. Na2CO3����D. NaOH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)д��N2�Ľṹʽ��________��
(2)д��1��2-��������Ľṹ��ʽ��_________��
(3)д����ϩ��ˮ�����ӳɷ�Ӧ�Ļ�ѧ����ʽ�� _____________��
(4)��֪0.2molҺ̬��(N2H4)��������Һ̬˫��ˮ��Ӧ�����ɵ�����ˮ�������ų�128 kJ���������˷�Ӧ���Ȼ�ѧ����ʽ��____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com