
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)今有如下两个热化学方程式:则a _____ b (填“>”、“=”或“<”)
H2(g)+![]() O2(g)═H2O (l) △H1=a kJmol﹣1
O2(g)═H2O (l) △H1=a kJmol﹣1
H2(g)+![]() O2(g)═H2O (g) △H2=b kJmol﹣1
O2(g)═H2O (g) △H2=b kJmol﹣1
(2)拆开lmol气态物质中某种共价键需要吸收的能量叫键能,部分化学键键能如表。
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | a | 945 |
已知反应N2(g)+3H2(g)=2NH3(g) △H=-93 kJmol﹣1,试根据表中所列键能数据计算a=______________。
(3)利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+ CO(g)═ CH3OH(g) △H1
②2CH3OH(g)═ CH3OCH3(g)+ H2O(g) △H2
③3 H2(g)+3CO(g)═ CO2(g) + CH3OCH3(g) △H3
反应③为制取二甲醚的第3步反应,利用△H1和△H2计算△H3时,还需要利用________反应的△H。
(4)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如图。
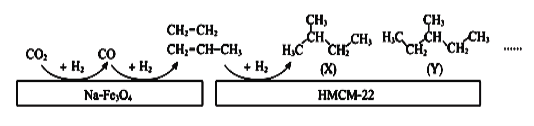
图中CO2转化为CO的反应为: CO2(g)+H2(g) = CO(g)+H2O(g) △H= +41kJ/mol
已知:2CO2(g) + 6H2(g) = C2H4(g) + 4H2O(g) △H= -128kJ/mol
则图中CO转化为C2H4的热化学方程式是______________________________________。
【答案】< 391 2H2(g) + O2(g) = 2H2O(g),2CO+ O2(g) = 2CO2(g) 2CO(g) +4H2(g) = CH2=CH2(g) + 2H2O(g) △H= - 210 kJ/mol
【解析】
⑴两个反应均为放热反应,生成液态水放出的热量多,但焓变反而小,所以则a < b,
故答案为:<;
⑵△H = - 93 = 436×3 + 945 – 6a,a = 391
故答案为:391
⑶利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+ CO(g)═ CH3OH(g) △H1
②2CH3OH(g)═ CH3OCH3(g)+ H2O(g) △H2
③3 H2(g)+3CO(g)═ CO2(g) + CH3OCH3(g) △H3
利用△H1和△H2计算△H3时,①×2 + ②,得到4H2(g)+2CO(g)═ H2O(g)+ CH3OCH3(g)还需要利用2H2(g) + O2(g) == 2H2O(g),2CO+ O2(g) == 2CO2(g)
反应的△H。
故答案为2H2(g) + O2(g) = 2H2O(g),2CO+ O2(g) = 2CO2(g);
⑷图中CO2转化为CO的反应为: CO2(g)+H2(g) = CO(g)+H2O(g) △H= +41kJ/mol
已知:2CO2(g) + 6H2(g) = C2H4(g) + 4H2O(g) △H= -128kJ/mol
将第二个方程式减去第一个方程式的2倍得到CO转化为C2H4的热化学方程式是
2CO(g) +4H2(g) = CH2=CH2(g) + 2H2O(g) △H= - 210 kJ/mol


科目:高中化学 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力大于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
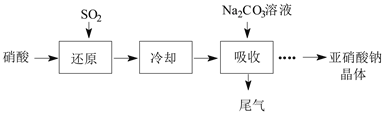
已知:Ⅰ.Na2CO3+NO+NO2=2NaNO2+CO2;Na2CO3+2NO2=NaNO2+NaNO3+CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___(填元素符号)。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___。
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___。
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00mL0.100mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL0.100mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度___(“偏大”、“偏小”或“无影响”),原因是___。
②通过计算,该样品中NaNO2的质量分数是___,可能含有的杂质有___(写出其中一种即可)。
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时,向2L密闭容器中通入一定量的气体X和Y,发生反应:3X(g)+Y(g)![]() 2Z(g) ΔH>0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是( )
2Z(g) ΔH>0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是( )
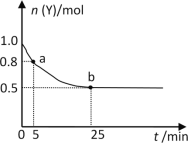
A.该反应为放热反应
B.0~5min内,以X表示的化学反应速率是0.02mol·L-1·min-1
C.b点时该反应达到了最大限度,反应停止
D.25min时,c(Z)=0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。已知:Cr3+![]() Cr(OH)3
Cr(OH)3![]() CrO2-。
CrO2-。
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式_______________________。
②用离子方程式表示溶液pH不能超过10的原因__________________________________。
③若处理后的废水中残留的c(Fe3+)=2×10-13 mol/L,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合成氢氧化物沉淀而除去。
①写出阴极的电极反应式__________________________。
②电解法中加入氯化钠的作用是______________________。
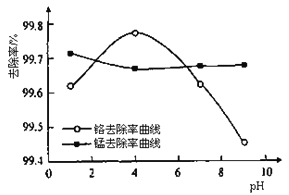
(3)某化学兴趣小组以含+6价铬和+2价锰的工业废水为试样,研究铁屑用量和pH对废水中铬、锰去除率的影响。
①取100mL废水于250 mL三角瓶中,调节pH到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图所示。则在pH一定时,废水中铁屑用量为____________时,锰、铬去除率最好。
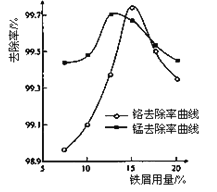
②取100mL废水于250 mL三角瓶中,加入规定量铁粉,调成不同的pH。得到pH对铬和锰去除率的影响如下图所示。则在铁屑用量一定时,废水pH=__________时锰、铬去除率最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、用符号“>”、“<”或“=”连接下列各项关系。
(1)第一电离能:Na__________Mg,Mg__________Ca。
(2)电负性:O__________F,F__________Cl。
(3)能量高低:ns__________ (n+1)s,ns__________np。
(4)主族序数__________该原子的价电子数__________元素最高正化合价。
II、固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,该物质适当加热就分解成两种气体,试完成:
(1)固体A属于__________晶体,它的电子式为__________。
(2)A溶于水后溶液呈____性(填“酸”、“碱”或“中”),其原因是(用化学方程式表示)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.请将下列物质的转化或分离方法的序号填在横线上(每一项只填写一种方法),并指出是属于化学变化还是物理变化。
①溶解 ②裂解 ③分馏 ④裂化 ⑤干馏 ⑥蒸馏 ⑦电解 ⑧过滤 ⑨萃取
(1)把煤转化为焦炉气、煤焦油和焦炭等_______、_________变化。
(2)从原油中分离出汽油、煤油、柴油等__________、__________变化。
(3)将重油转化为汽油_____________、__________变化。
(4)将海水淡化_______、_____变化。
Ⅱ.在鸡蛋清溶液中加入以下各物质时:
(1)加入大量饱和硫酸铵,产生絮状沉淀,此过程叫做蛋白质的________________。
(2)加入浸制动物标本时用的福尔马林溶液(主要成分为甲醛),产生絮状沉淀此过程称为蛋白质的______。
(3)加入浓硝酸并微热,现象为________,这是由于浓硝酸与蛋白质发生了____________反应的缘故。
(4)乙醇(CH3CH2OH)在铜做催化剂时与氧气反应的方程式________________。
(5)制备聚乙烯的化学方程式________________________________________________。
(6)制备一氯乙烷的方程式_____________________________________________。
(7)制备1,2—二氯乙烷的方程式___________________________________________。
Ⅲ.①花生油中所含人体所需的主要营养物质为________(填“糖类”、“油脂”或“蛋白质”)。
②吃饭时,咀嚼米饭一会儿后感觉有甜味,是因为淀粉发生了____________(填字母)反应。
A.分解 B.水解 C.裂解
(2)在日常生活中,下列做法错误的是________。
A.用燃烧法鉴别毛织品和棉织品
B.用纯碱洗涤锅盖上的油渍
C.用闻气味的方法鉴别白酒和米醋
D.用淀粉溶液鉴别加碘食盐和不含碘的食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com