
����Ŀ��I���÷�����>������<������=���������и����ϵ��
(1)��һ�����ܣ�Na__________Mg��Mg__________Ca��
(2)�縺�ԣ�O__________F��F__________Cl��
(3)�����ߵͣ�ns__________ (n+1)s��ns__________np��
(4)��������__________��ԭ�ӵļ۵�����__________Ԫ����������ϼۡ�
II������A�Ļ�ѧʽΪNH5����������ԭ�ӵ�����㶼������Ӧ��ϡ������ԭ�ӵ��Ӳ�ṹ���������ʵ����Ⱦͷֽ���������壬����ɣ�
(1)����A����__________���壬���ĵ���ʽΪ__________��
(2)A����ˮ����Һ��____�ԣ�������������������������������ԭ���ǣ��û�ѧ����ʽ��ʾ��_______��
���𰸡�< > < > < < = = ���� 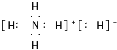 �� NH4H+H2O=NH3��H2O+H2��
�� NH4H+H2O=NH3��H2O+H2��
��������
I.(1)ͬһ���ڵ�Ԫ�أ���һ��������ԭ�����������������ͬһ�����Ԫ�أ���һ��������ԭ���������������С��
(2)Ԫ�صķǽ�����Խǿ���縺�Ծ�Խ��
(3)��ͬ�ܲ㣬�ܲ�ߵ������ߣ�ͬһ�ܲ�IJ�ͬ�ܼ�����s��p��d��f˳���������ӣ�
(4)����ԭ�ӵ�λ�������Է����жϣ�
II. (1)����A�����ʿ��жϣ�A���⻯泥��������ӻ����
(2)A�е������Ӿ��л�ԭ�ԣ���ˮ����������������������ˮ��ˮ������Ӧ����������һˮ�ϰ�����Һ�Լ��ԡ�
I.(1)ͬһ���ڵ�Ԫ�أ���һ��������ԭ�����������������Na��Mg��ͬһ���ڵ�Ԫ�أ�����ԭ������Խ��ԭ�Ӱ뾶ԽС��ʧȥ����Խ�ѣ�������Խ�ʵ�һ������Na<Mg��Mg��Ca��ͬһ�����Ԫ�أ����ϵ��£�ԭ�Ӱ뾶����������������ԭ�Ӻ˵���������С�����Ե�һ��������С���ʵ�һ������Mg>Ca��
(2)Ԫ�صķǽ�����O<F�����Ե縺��O<F��Ԫ�صķǽ�����F>Cl�����Ե縺��F>Cl��
(3)���ݺ�����������ĸߵͼ�Χ��ԭ�Ӻ��˶�ʱ��˵�Զ������ԭ�Ӻ�������˶��Ŀռ�ֳɲ�ͬ���ܲ㣬�ܲ�����Խ������Խ�ߣ���������ns<(n+1)s������ͬһ�ܲ�IJ�ͬ�ܼ������������ɸߵ���˳���Ϊs��p��d��f����������ns<np��
(4)����ԭ�Ӻ�����������������Ԫ�ص�������������Ԫ�ص���������ϼ�����
II.(1)����A�����ʿ��жϣ�A���⻯泥�����ʽΪ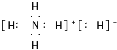 �������ӻ�����γ����Ӿ��壻
�������ӻ�����γ����Ӿ��壻
(2)A�е������Ӿ��л�ԭ�ԣ���ˮ����������������NH4H����ˮ��ˮ������Ӧ����������һˮ�ϰ���ʹ��Һ�Լ��ԣ���Ӧ����ʽΪ��NH4H+H2O�TNH3H2O+H2����


 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ��������᳧����(��Ҫ�ɷ�Ϊ���������P����FeS��SiO2��)�Ʊ��������̷�(FeSO4��7H2O)�������Ļ�ѧʽ�ɱ�ʾΪ[Fe2(OH)n(SO4)3��0.5n]m����Ҫ�����������£�
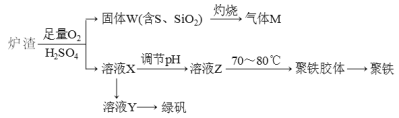
����˵���������
A.¯����FeS��ϡ�����������Ӧ�����ӷ���ʽΪ��4FeS+3O2+12H+=4Fe3++4S��+6H2O
B.����M�ijɷ���SO2��ͨ��H2O2��Һ�õ����ᣬ��ѭ��ʹ��
C.����ҺX�м���������ۣ���ַ�Ӧ����˵õ���ҺY���پ����ɼ����̷�
D.��ҺZ��pHӰ�������������������������pHƫС�������¾�����������������ƫС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ�����H2ȡ��CH4��CH4��O2���ó�CO2��H2����Ӧ�٣���Ȼ��CH4��O2��Ӧ��������CO2��H2O����Ӧ�ڣ�������ˮ����ʱ��H2O��CH4��Ӧ����Ӧ�ۣ����±� Ϊ������Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ��K��

��1����Ӧ�ٵ�ƽ�ⳣ��K�ٵı���ʽΪ_______________��
��2����Ӧ�٢ڢ۵�ƽ�ⳣ��K�١�K�ڡ�K��֮��Ĺ�ϵΪK��=_____________���ú�K�١� K�۵�ʽ�ӱ�ʾ������Ӧ�٢ڢ۵ķ�Ӧ�ʱ䣺��H�١���H�ڡ���H��֮��Ĺ�ϵΪ��H��= _____________���ú���H�ڡ���H�۵�ʽ�ӱ�ʾ����
��3�����������£���Ӧ�۵������뷴Ӧ���̹�ϵӦ��Ӧ��ͼ�е�_____________����Ӧ�� �������뷴Ӧ���̹�ϵӦ��Ӧ��ͼ�е�_____________��

��4��Ϊʹ��Ӧ�����ܰ�����H2�ķ�����У���ֻ���Ƿ�Ӧ�ۣ��Ҳ����ͷ�Ӧ���ʣ��ɲ� ȡ__________��ʩ����ֻ���Ƿ�Ӧ�٢ڣ�����ȡ���´�ʩ�⣬���ɲ�ȡ_____________��д��������ʩ���ɣ���
��5��250��ʱ�������Ͻ�Ϊ����������CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)����40L ���ܱ�������ͨ��6molCO2(g)��6molCH4(g)��ƽ��ʱ�����ϵ��CH4��������� Ϊ10%������������ܶ�Ϊ______g/L��CO2��ת����Ϊ__________��������λ��Ч���֣���
2CO(g)+2H2(g)����40L ���ܱ�������ͨ��6molCO2(g)��6molCH4(g)��ƽ��ʱ�����ϵ��CH4��������� Ϊ10%������������ܶ�Ϊ______g/L��CO2��ת����Ϊ__________��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�±����AgX(X��Cl����Br����I��)��Ag2CrO4�ij����ܽ�ƽ��������ͼ��ʾ��������p(Ag��)��ʾ����lgc(Ag��)����������Y��ʾ����lgc(X��)����lgc(CrO42��)��������˵����ȷ����
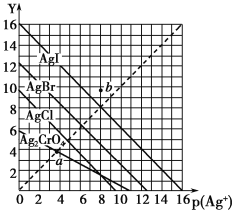
A. a���ʾc(Ag��)��c(CrO42��)
B. b��ɱ�ʾAgI�ı�����Һ
C. ���¶���AgI��KspԼΪ1��10��16
D. ���¶���AgCl��AgBr������Һ�У�c(Cl��)<c(Br��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˺������û�ѧ�ܣ�ȷ����ȫ���������������Ҫ��ֿ��ǻ�ѧ��Ӧ�ķ�Ӧ�ȣ�����ȡ��Ӧ��ʩ����ѧ��Ӧ�ķ�Ӧ��ͨ����ʵ����вⶨ��Ҳ�ɽ����������㡣
��1���������������Ȼ�ѧ����ʽ����a _____ b ����������������������������
H2��g��+![]() O2��g���TH2O ��l�� ��H1��a kJmol��1
O2��g���TH2O ��l�� ��H1��a kJmol��1
H2��g��+![]() O2��g���TH2O ��g�� ��H2��b kJmol��1
O2��g���TH2O ��g�� ��H2��b kJmol��1
��2����lmol��̬������ij�ֹ��ۼ���Ҫ���յ������м��ܣ����ֻ�ѧ�����������
��ѧ�� | H��H | N��H | N��N |
����/kJmol��1 | 436 | a | 945 |
��֪��ӦN2��g��+3H2��g����2NH3��g�� ��H��-93 kJmol��1���Ը��ݱ������м������ݼ���a=______________��
��3������ˮú���ϳɶ����ѣ�CH3OCH3����������Ӧ���£�
��2H2��g��+ CO��g���T CH3OH��g�� ��H1
��2CH3OH��g���T CH3OCH3��g��+ H2O��g�� ��H2
��3 H2��g��+3CO��g���T CO2��g�� + CH3OCH3��g�� ��H3
��Ӧ��Ϊ��ȡ�����ѵĵ�3����Ӧ��������H1����H2������H3ʱ������Ҫ����________��Ӧ����H��
��4���п�Ժ������ѧ�����о����Ŀ�����Ա���������״���Na-Fe3O4��HMCM-22 �ı��潫CO2ת��Ϊ�������������ͼ��
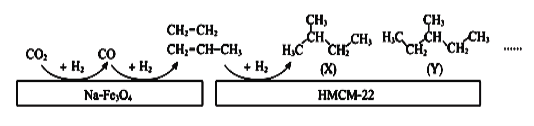
ͼ��CO2ת��ΪCO�ķ�ӦΪ�� CO2(g)+H2(g) = CO(g)+H2O(g) ��H= +41kJ/mol
��֪��2CO2(g) + 6H2(g) = C2H4(g) + 4H2O(g) ��H= -128kJ/mol
��ͼ��COת��ΪC2H4���Ȼ�ѧ����ʽ��______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У����ڼӳɷ�Ӧ����( )
A. CH3Cl+Cl2 �� CH2Cl2 + HCl
B. CH2=CH2+HO��H �� HOCH2��CH3
C. 2CH3CH2OH+O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
D. ![]() +Br2
+Br2![]()
![]() + HBr
+ HBr
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ƣ�Na2S2O5��������ʳƷƯ�������Ʊ�����������ͼ��
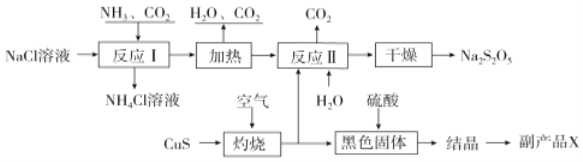
��֪����Ӧ������2NaHSO3![]() Na2S2O5��H2O�ȶಽ��Ӧ��
Na2S2O5��H2O�ȶಽ��Ӧ��
��1��ʵ������ȡ�����Ļ�ѧ����ʽ��______��
��2����ӦI�Ļ�ѧ����ʽΪ______��
��3����������ʱ������Ӧ�Ļ�ѧ����ʽ��______��
��4����֪Na2S2O5��ϡ���ᷴӦ�ų�SO2�������ӷ���ʽΪ______��
��5������ƷX�Ļ�ѧʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ 8 ��Ԫ�ص����ʡ��������±����У��������ڵڶ���������ڡ�
�� | �� | �� | �� | �� | �� | �� | �� | |
ԭ�Ӱ뾶(10��10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
�����ͻ��ϼ� | ��2 | ��1 | ��5 | ��7 | ��1 | ��5 | ��3 | |
��2 | ��3 | ��1 | ��3 |
�ش��������⣺
��1���ܵ�Ԫ��������_____�����Ԫ�ط�����_____������Ԫ�����ڱ��е�λ���ǣ����ڡ��壩_____ ��
��2��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��_____��������________�� ������ǿ�Ļ�����ĵ���ʽ�ǣ�_________�� ��_____�����������������������������
��3���ٵ�����⻯��ĵ���ʽΪ_____, �ߵ�����⻯��ĵ���ʽΪ_____���ṹʽΪ_____��
��4��д���ߵ�����������Ӧˮ����������⻯�ﷴӦ�Ļ�ѧ����ʽ��_________________ ��
��5��д��������������Ӧˮ������ݵ��⻯��ˮ��Һ��Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£��������г���![]() ���������г���
���������г���![]() ,������������ȷ���ǣ���
,������������ȷ���ǣ���
A. ���������������ȣ��ס�����������������ܶ�֮��Ϊ35:37
B. ���������������ȣ��ס��������������������֮��Ϊ35:37
C. ����������������ȣ��ס�������������������������֮��Ϊ37:35
D. ���������������ȣ��ס�������������������������֮��Ϊ9:10
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com