
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如图:
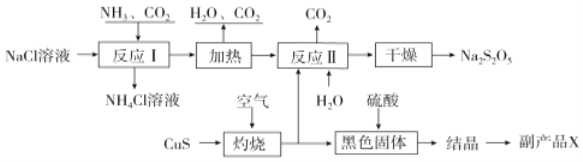
已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:______。
(2)反应I的化学方程式为______。
(3)“灼烧”时发生反应的化学方程式:______。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为______。
(5)副产品X的化学式是______。
【答案】2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2CuS+3O2
2NH3↑+CaCl2+2H2O NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2CuS+3O2![]() 2CuO+2SO2 S2O52-+2H+=2SO2↑+H2O CuSO4·5H2O
2CuO+2SO2 S2O52-+2H+=2SO2↑+H2O CuSO4·5H2O
【解析】
由制备流程可知,反应Ⅰ为生成NaHCO3,加热生成Na2CO3。在CuS在空气中灼烧,得到SO2,SO2通入Na2CO3溶液中,制得NaHSO3。加热NaHSO3生成Na2S2O5。黑色固体为CuO,加入硫酸变成硫酸铜溶液,结晶可得副产品。
(1)氯化铵和氢氧化钙固体混合加热制氨气,发生反应的化学方程式为2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O;
(2)流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和NaHCO3,反应Ⅰ的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(3)硫化铜灼烧一定生成氧化铜和二氧化硫,反应的化学方程式为:2CuS+3O2![]() 2CuO+2SO2;
2CuO+2SO2;
(4)根椐提示可知生成二氧化硫和水,Na2S2O5与稀硫酸反应放出SO2和水,反应的离子方程式为S2O52-+2H+=2SO2↑+H2O;
(5)上述分析可知,氧化铜与硫酸反应生成硫酸铜,蒸发浓缩,冷却结晶,过滤洗涤,得出硫酸铜晶体,副产品X的化学式是CuSO4·5H2O。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】硼位于第ⅢA族,三氯化硼是无色、强烈臭味的发烟液体或气体,属于化学危险品,主要用于半导体硅的掺杂源、有机合成的催化剂,还应用于高纯硼、有机硼(如:乙硼烷B2H6)的制取。某同学设计利用Cl2和单质B制备三氯化硼(BCl3)的装置示意图。查阅资料:①BCl3沸点12.5℃,熔点-107.3℃,易潮解;②2B+6HCl![]() 2BCl3↑+3H2↑;③硼与硅“对角线”相似,都能与氢氧化钠溶液反应。请回答下列问题:
2BCl3↑+3H2↑;③硼与硅“对角线”相似,都能与氢氧化钠溶液反应。请回答下列问题:
(1)装置A中二氧化锰能与浓盐酸在加热条件下发生反应制取氯气,该反应的离子方程式:______________________________,洗气瓶G中用Na2SO3溶液除去Cl2反应的化学方程式是____________________________。
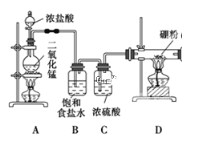
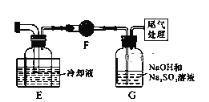
(2)E装置的作用是_________________________,如果拆去B装置,可能导致的后果是:_____________________________________________________________。
(3)写出D装置中发生反应的化学方程式:______________________________,实验中可用一个盛装__________(填:试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)BCl3遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应方程式:____________。
(5)为了顺利完成实验,正确的操作是____________(填:数字编号)。
①先点燃A处酒精灯,后点燃D处酒精灯 ②先点燃D处酒精灯,后点燃A处酒精灯③同时点燃A、D处酒精灯
(6)硼纤维是在金属丝上沉积无定形的硼而形成的无机纤维,通常在炽热的钨丝表面发生如下的反应:3H2+2BCl3 =2B+6HCl↑。要想验证制得的产品中是否含硼粉:应取少量样品于试管中,滴加浓____________(填:化学式)溶液,观察是否有气泡产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时,向2L密闭容器中通入一定量的气体X和Y,发生反应:3X(g)+Y(g)![]() 2Z(g) ΔH>0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是( )
2Z(g) ΔH>0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是( )
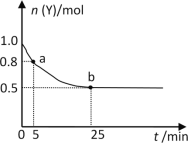
A.该反应为放热反应
B.0~5min内,以X表示的化学反应速率是0.02mol·L-1·min-1
C.b点时该反应达到了最大限度,反应停止
D.25min时,c(Z)=0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、用符号“>”、“<”或“=”连接下列各项关系。
(1)第一电离能:Na__________Mg,Mg__________Ca。
(2)电负性:O__________F,F__________Cl。
(3)能量高低:ns__________ (n+1)s,ns__________np。
(4)主族序数__________该原子的价电子数__________元素最高正化合价。
II、固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,该物质适当加热就分解成两种气体,试完成:
(1)固体A属于__________晶体,它的电子式为__________。
(2)A溶于水后溶液呈____性(填“酸”、“碱”或“中”),其原因是(用化学方程式表示)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.请将下列物质的转化或分离方法的序号填在横线上(每一项只填写一种方法),并指出是属于化学变化还是物理变化。
①溶解 ②裂解 ③分馏 ④裂化 ⑤干馏 ⑥蒸馏 ⑦电解 ⑧过滤 ⑨萃取
(1)把煤转化为焦炉气、煤焦油和焦炭等_______、_________变化。
(2)从原油中分离出汽油、煤油、柴油等__________、__________变化。
(3)将重油转化为汽油_____________、__________变化。
(4)将海水淡化_______、_____变化。
Ⅱ.在鸡蛋清溶液中加入以下各物质时:
(1)加入大量饱和硫酸铵,产生絮状沉淀,此过程叫做蛋白质的________________。
(2)加入浸制动物标本时用的福尔马林溶液(主要成分为甲醛),产生絮状沉淀此过程称为蛋白质的______。
(3)加入浓硝酸并微热,现象为________,这是由于浓硝酸与蛋白质发生了____________反应的缘故。
(4)乙醇(CH3CH2OH)在铜做催化剂时与氧气反应的方程式________________。
(5)制备聚乙烯的化学方程式________________________________________________。
(6)制备一氯乙烷的方程式_____________________________________________。
(7)制备1,2—二氯乙烷的方程式___________________________________________。
Ⅲ.①花生油中所含人体所需的主要营养物质为________(填“糖类”、“油脂”或“蛋白质”)。
②吃饭时,咀嚼米饭一会儿后感觉有甜味,是因为淀粉发生了____________(填字母)反应。
A.分解 B.水解 C.裂解
(2)在日常生活中,下列做法错误的是________。
A.用燃烧法鉴别毛织品和棉织品
B.用纯碱洗涤锅盖上的油渍
C.用闻气味的方法鉴别白酒和米醋
D.用淀粉溶液鉴别加碘食盐和不含碘的食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示操作能实现实验目的的是( )
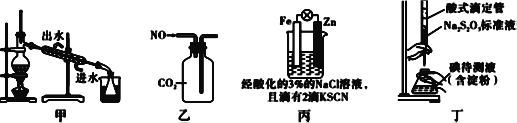
A. 用图甲装置分离碘和四氯化碳,在锥形瓶中收集到碘单质
B. 用图乙装置收集NO气体
C. 用图丙装置验证牺牲阳极的阴极保护法
D. 用图丁装置测定待测液中I2的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含氢原子数与___个H2O分子中所含氢原子数相等。
(2)含0.4molAl3+的Al2(SO4)3中所含的SO42-的物质的量是___。
(3)2.3gNa中含___mole-,在跟足量水反应中失去___mole-。
(4)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com