
【题目】下列表示资源开发、回收、利用原理的反应方程式不正确的是( )
A.海带提碘时用酸性H2O2氧化I-:H2O2+2I-+2H+=2H2O+I2
B.将煤气化为可燃性气体:C+H2O![]() CO+H2
CO+H2
C.利用H2还原MgO冶炼金属Mg:H2+MgO![]() Mg+H2O
Mg+H2O
D.可以用铝和氧化铁制备铁单质:2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__个电子层,最外层有__个电子,写出砷原子最外层电子的轨道表示式:__。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__(用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__强于__(填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
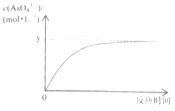
①写出该反应平衡常数的表达式K=___。
②不能判断反应达到平衡状态的是___(选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下溶度积常数:Ksp[Pb(OH)2]=2×10-15,Ksp[Fe(OH)2]=8×10-15。当溶液中金属离子浓度小于10-5molL-1视为沉淀完全。向20mL含0.10molL-1Pb2+和0.10molL-1Fe2+的混合溶液中滴加0.10molL-1NaOH溶液,金属阳离子浓度与滴入NaOH溶液体积的关系曲线如图所示,则下列说法正确的是( )

A.曲线A表示c(Pb2+)的曲线
B.当溶液pH=8时,Fe2+开始沉淀,Pb2+沉淀完全
C.滴入NaOH溶液体积大于30mL时,溶液中c(Fe2+)=4c(Pb2+)
D.室温下,滴加NaOH溶液过程中, 比值不断增大
比值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
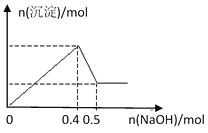
A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向VmL0.1mol/L氨水中滴加等物质的量浓度的稀H2SO4,测得混合溶液的温度和pOH[pOH=-lgc(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化),下列说法不正确的是( )
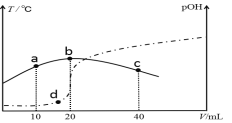
A. a、b、c三点由水电离的c(H+)依次减小
B. V=40
C. b点时溶液的pOH>pH
D. a、b、d三点对应NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将4molNH3和4molO2混合于固定容积为2L的密闭容器中,发生反应:4NH3(g)+5O2(g)=4X(g)+6H2O(g)。2min后该反应达到平衡,生成3molH2O。则:
(1)X的化学式为___。
(2)O2的转化率为___(O2转化率=已反应的O2的量/O2的总量×100%)。
(3)0~2min内,v(NH3)=___mol·L-1·min-1。
(4)燃料电池是一种高效、环境友好型发电装置。一种燃料电池的电解质溶液为NaOH溶液,负极通入NH3,正极通入空气,产物对环境无污染,则负极的电极反应式为___,电路中每通过1mol电子,消耗标准状况下的空气___(假设空气中O2的含量为20%)L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为_____。
(2)下列关于反应后的溶液说法不正确的是____(填字母)。
a.实验②反应后溶液中只存在着两个平衡
b.实验②反应后溶液中:c(A-)+c(HA)>0.1mol·L-1
c.实验②反应后溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
d. 实验①反应后的溶液中由水电离出的c(OH-)=10-9mol·L-1;x>0.2mol·L-1
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(3)写出该电池工作时负极的电极反应式____。
(4)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测不正确的是
A.K+不一定存在B.100mL溶液中含0.02mol![]()
C.Cl-不一定存在D.Ba2+、Mg2+不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 17 g H2O2与17 g H2S所含的电子数均为9NA
B. 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C. 0.1 mol Cl2通入适量水中,转移电子数为0.2NA
D. 2 L pH =3的醋酸与足量的锌反应,产生H2分子数为10-3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com