
【题目】Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为_____。
(2)下列关于反应后的溶液说法不正确的是____(填字母)。
a.实验②反应后溶液中只存在着两个平衡
b.实验②反应后溶液中:c(A-)+c(HA)>0.1mol·L-1
c.实验②反应后溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
d. 实验①反应后的溶液中由水电离出的c(OH-)=10-9mol·L-1;x>0.2mol·L-1
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(3)写出该电池工作时负极的电极反应式____。
(4)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为____。
【答案】HA+OH-=A-+H2O a d H2+2OH--2e-=2H2O )80%
【解析】
(1)HA溶液和KOH溶液反应生成水和KA,据此书写离子反应方程式;
(2)a、HA为弱酸中A-存在电离平衡和水解平衡,水存在电离平衡,据此进行分析;
b、溶液中存在电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH-),溶液呈中性,即c(OH-)=c(H+),则c(K+)=c(A-),所以c(A-)+c(HA)>c(K+),据此进行分析;
c、据电荷守恒进行分析;
d、反应①结束后,溶液中溶质为KA,会促进水的电离;实验②结束后溶液为中性,说明酸过量;
(3)负极失去电子方式氧化反应,据此进行分析;
(4)根据热化学反应方程式计算生成1mol水放出的能量,再利用燃料电池释放228.8kJ电能来计算电池的能量转化率。
(1)HA溶液和KOH溶液反应生成水和HA,故化学方程式为HA+KOH=KA+H2O,故离子反应方程式为HA+OH===A+H2O,
(2)a、实验②反应后溶液中有HA和KA两种溶质,HA为弱酸、存在电离平衡,A存在水解平衡,水存在电离平衡,故溶液中存在着三个平衡而不是两个平衡,故a选;
b、实验②反应后溶液中存在电荷守恒,即c(K+)+c(H+)=c(A)+c(OH),溶液呈中性,即c(OH)=c(H+),则c(K+)=c(A),所以c(A)+c(HA)>c(K+),c(K+)=0.5c(KOH)=0.1mo1L1,则c(A)+c(HA)>0.1mo1L1,故b不选;
c、溶液中存在电荷守恒,即c(K+)+c(H+)=c(A)+c(OH),溶液呈中性,即c(OH)=c(H+),则c(K+)=c(A),溶液呈中性,KA为强碱弱酸盐,显碱性,要想使溶液呈中性,则增加HA的浓度,即c(K+)=c(A)>c(OH)=c(H+),故c不选;
d、反应①结束后,溶液中溶质为KA,A-水解会促进水的电离,溶液中c(H+)=10-9mol/L,故c(OH-)水=c(OH-)=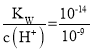 =10-5mol/L;反应②结束后,pH=7,即HA过量,即x>0.2;故d选;故答案为:ad;
=10-5mol/L;反应②结束后,pH=7,即HA过量,即x>0.2;故d选;故答案为:ad;
(3)负极失去电子方式氧化反应,故电极反应方程式为H2+2OH2e=2H2O;
(5)由2H2(g)+O2(g)═2H2O(I) △H=572kJ·mol1可知,生成1mol水时放出的热量为572KJ×0.5=286kJ,则电池的能量转化率为为![]() ×100%=80%。
×100%=80%。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 常温常压下,11.2L二氧化碳含有的原子数等于1.5NA
B. 100mL1mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,22.4LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为2NA
D. 常温常压下,48gO2与O3混合物含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料.工业上提取铝的工艺流程如下:
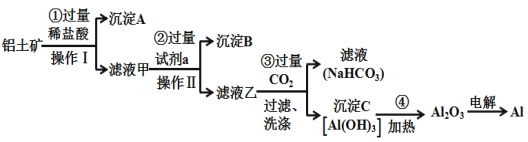
(1)沉淀A的化学式是____,沉淀B的化学式是____,滤液甲中所含金属离子是___、____,试剂a的化学式为__________;
(2)步骤③中通入过量CO2,产生沉淀C的离子方程式为___________________________________;
(3)Al2O3中所含的化学键的类型为________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其反应方程式为_____________________________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂,下列氧化物中不能与铝粉组成铝热剂的是(___________)
a.MgO b.V2O5 c.Fe3O4 d.MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示资源开发、回收、利用原理的反应方程式不正确的是( )
A.海带提碘时用酸性H2O2氧化I-:H2O2+2I-+2H+=2H2O+I2
B.将煤气化为可燃性气体:C+H2O![]() CO+H2
CO+H2
C.利用H2还原MgO冶炼金属Mg:H2+MgO![]() Mg+H2O
Mg+H2O
D.可以用铝和氧化铁制备铁单质:2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子的浓度为( )。
A.0.1(b-2a) mol·L-1B.10(2a-b) mol·L-1
C.10(b-a) mol·L-1D.10(b-2a) mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为_________,碳原子和氧原子的个数比为________ ,该混合气体的摩尔质量为__________ 。
(2)12.4g含Na2X中含Na+0.4mol,则Na2X的摩尔质量是________ ,X的相对原子质量是____________。
(3)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L人造空气的质量是4.8g,其中氧气和氦气的分子数之比是_____________,氧气的质量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3 杂质。利用明矾石制备氢氧化铝的流程如下:
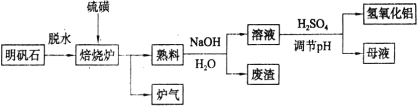
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S=2Al2O3+9SO2,若生成1molAl2O3,则转移的电子数为______。
(2)将标况下1.12L炉气通入100mL0.5mol/LNaOH 溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为______。
(3)熟料溶解时反应的离子方程式为_________。
(4)检验废渣中含有Fe2O3所需的试剂是______________。
(5)母液中溶质主要成分的化学式为_______,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溴苯乙烯(![]() )与丙烯(CH2=CH-CH3)发生聚合反应的产物是一种高分子阻燃剂,具有低毒、热稳定好等优点。
)与丙烯(CH2=CH-CH3)发生聚合反应的产物是一种高分子阻燃剂,具有低毒、热稳定好等优点。
完成下列各小题:
(1)写出该产物的结构简式:___。
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制中间体![]() 。写出该两步反应所需的试剂及条件____、____。
。写出该两步反应所需的试剂及条件____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX和2molY发生反应:X(g)+2Y(g)![]() mZ(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入5molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
mZ(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入5molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A. 两次平衡的平衡常数相同B. m=3
C. X与Y的平衡转化率之比为1:2D. 第二次平衡时,Z的浓度为0.4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com