
【题目】下列对古文献记载内容理解错误的是
A.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐
B.《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和槽入甑,蒸令气上![]() 其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
C.《本草经集注》有记载:“以火烧之、紫青烟起,乃真硝石也”,区分硝石(KNO3)和朴硝(Na2SO4),该方法利用了焰色反应
D.《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对硝酸钾提取涉及到升华操作
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】如图是某“泡腾片”的标签。将这样一粒泡腾片放入水中,药片完全溶解,同时产生了大量气泡.这个过程( )

A.溶解了500mg的Ca2+
B.释放了112mL的气体
C.发生了发应:CO32-+2H+=CO2↑+H2O
D.说明了柠檬酸的酸性比碳酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用乙烯与甲苯为主要原料,按下列路线可合成有机物E、F:
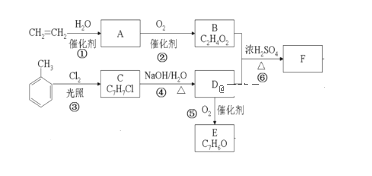
请回答:
(1)B中官能团的名称是_____,反应④的反应类型是_____。
(2)F的结构简式______________。
(3)反应①的化学方程式是___________,反应⑤的化学方程式是_________。
(4)下列有关说法不正确的是________。
A.![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
B.E能与新制的Cu(OH)2悬浊液发生反应,但B不能
C.1molE和足量H2反应,最多消耗4molH2
D.D的同分异构体中能与NaOH溶液发生反应的有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)FeCl3的水溶液呈___(填“酸性”、“碱性”或“中性”),原因是_____(用离子方程式表示);实验室配制FeCl3的水溶液时,需加入______;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(II)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3处
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)某次滴定时的滴定管中的液面如图所示,其读数为_______mL。

(2)根据下列数据:

请计算待测烧碱溶液的浓度为______mol/L。
(3)下列实验操作会使实验结果偏高的是_______。
A.锥形瓶用待测液润洗后再注入待测液
B.酸式滴定管未用标准液润洗,便装入标准液
C.酸式滴定管滴定前俯视读数,滴定后仰视读数
D.酸式滴定管滴定前有气泡,滴定后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工产品为原料合成聚酯类功能高分子材料R及某药物合成原料E的一种合成路线如下(部分反应条件和产物略去):
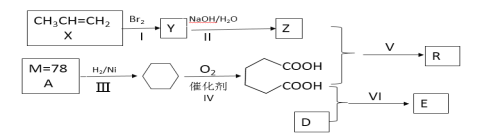
已知D与乙醇属于同系物,E在核磁共振氢谱上有3组峰且峰面积比为2∶2∶3
回答下列问题:
(1)Y的名称是____;R的官能团名称是____;E的分子式是__________。
(2)反应Ⅵ的反应类型是_____;X最多有___________个原子共面。
(3)写出II反应的化学方程式__________________。
(4)写出Y的其余几种同分异构体_________________。
(5)已知: ![]() ,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型示意图,下列说法正确的是
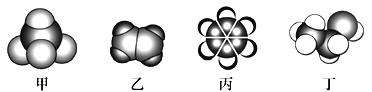
A. 甲能发生氧化反应
B. 乙通入溴的四氯化碳溶液,最后得到无色溶液不能和液溴反应
C. 煤干馏得到的煤焦油可以分离出丙,丙是无色无味的液态烃
D. 丁发生催化氧化得到的产物不能与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的元素A、B、C、D、E原子序数依次增大;A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期,且D的气态氢化物可以和其最高价氧化物的水化物发生氧化还原反应;E位于第四周期,其价电子层中只有一个电子,且内层都处于全充满状态。请回答下列问题:
(1)E原子的电子排布式为________,C和D的第一电离能较大的是________。
(2)CO43-中C的杂化方式为________,该离子的“VSEPR”模型为________形。
(3)C和D的简单阴离子半径由大到小的顺序为________,C和D最高价含氧酸的酸性由弱到强的顺序为________。
(4)某分子的结构式为:A—B=B—A,则该分子中σ键和π键的数目之比为_____,B2分子和一氧化碳分子互为等电子体,则一氧化碳的电子式为_____。
(5)向EDO4溶液中加入过量稀氨水,阳离子化学式为________,该离子的配位体为________。
(6)B能量最高的电子为________轨道上的电子,其轨道呈________形。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】规律提炼题组:同分异构体的书写
(1)同温同压下蒸气的密度是H2的43倍的烷烃的分子式________,其中一氯代物只有2种的结构简式为:_______________________。
(2)写出符合下列条件 的所有同分异构体的结构简式_______。
的所有同分异构体的结构简式_______。
a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
(3)CH2=CHOC2H5的同分异构体,与CH2=CHOC2H5有完全相同的官能团,写出所有可能的结构________。
学法题:通过此题的解答,总结同分异构体常见类型有____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、 F、G、H是周期表中前四周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
H | H是与D相邻的同主族元素,且原子半径:H>D |
(1) B元素符号为________ ,A与C以原子个数比为1:1形成的化合物的电子式为_______ ,用电子式表示C与E形成化合物的过程________ 。
(2) A、C、E所形成简单离子半径由大到小的顺序是____________ ,H的最高价氧化物对应水化物的化学式为_________ ,A、D、H的氢化物的沸点由高到低的顺序为____________________ 。
(3) 非金属性D_________ E(填“大于”或“小于”)。下列事实能证明这一结论的是________ (选填字母序号)。
a.E的熔点低于D
b.氢化物的还原性:D > E
c.最高价氧化物对应的水化物酸性:E > D
d.氢化物的酸性:E >D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com