
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则下列说法正确的是
2SO3(g)为放热反应,则下列说法正确的是
A.单位时间内生成2molSO2,同时生成1molO2,说明反应达到平衡状态
B.上述热化学反应方程式说明反应物的总键能小于生成物的总键能
C.升高温度,正反应速率增大,逆反应速率减小
D.将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后生成2molSO3(g)
科目:高中化学 来源: 题型:
【题目】卤族元素包括F、Cl、Br等元素。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是______。

(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为______,该功能陶瓷的化学式为______。
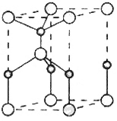
(3)BCl3和NCl3中心原子的杂化方式分别为__________和________。第一电离能介于B、N之间的第二周期元素有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式为C2H6O的有机化合物性质相同
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能
途径a:C CO+H2
CO+H2 CO2+H2O
CO2+H2O
途径b:C CO2
CO2
C.在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数
D.通过化学变化可以直接将水转变为汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的种类繁多,包含烃和烃的衍生物,官能团决定有机物的化学性质,请按要求回答下列问题。
I.已知乙二醇( ![]() )、丙三醇(
)、丙三醇(![]() )都与乙醇含有相同的官能团,都属于醇类物质,与乙醇具有相似的化学性质。
)都与乙醇含有相同的官能团,都属于醇类物质,与乙醇具有相似的化学性质。
请按要求完成下列问题:
(1)写出醇类物质都含有的官能团的电子式_______________。
(2)乙醇、乙二醇( ![]() )、丙三醇(
)、丙三醇(![]() )别与足量金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为______。
)别与足量金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为______。
(3)写出乙醇的催化氧化的化学方程式__________,反应类型:________ ;
(4)丙三醇(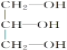 )与足量乙酸发生酯化反应的化学方程式(反应条件与乙醇酯化反应相同)_____。
)与足量乙酸发生酯化反应的化学方程式(反应条件与乙醇酯化反应相同)_____。
II.以下是用苯作原料制备一系列化合物的转化关系图,已知:R-NO2![]() R-NH2(其中-R代表烃基)
R-NH2(其中-R代表烃基)
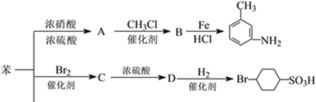
(5)写出A→B的化学反应方程式______,反应类型:_________。
(6)C中含有的官能团的名称为________;D的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造。以镍粉废料为原料制备Ni2O3的工艺如下:
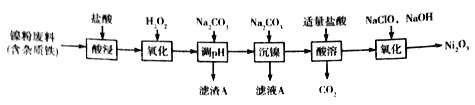
回答下列问题:
(1)Ni2O3中Ni的化合价为_________。
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是__________。
(3)加入H2O2“氧化”的离子方程式为_____________;滤渣A的主要成分是________(填化学式)。
(4)工艺中分步加入Na2CO3的作用是________;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为_________。
(5)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电流效率是指电解时,在电极上实际沉积的物质的量与理论析出量之比)及镍的成粉率的影响如图所示:
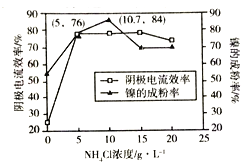
①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为______mol/L.
②当NH4Cl溶液的浓度大于15g/L时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应X(s)+3Y(g)![]() Z(g)+2W(g),在恒容绝热容器中加入1molX和3molY发生反应,说法正确的是
Z(g)+2W(g),在恒容绝热容器中加入1molX和3molY发生反应,说法正确的是
A.在反应的过程中,加入更多的X,化学反应速率加快
B.在反应的过程中,容器内的压强变小
C.容器内温度不变时,可以说明反应到达平衡状态
D.随着反应的进行,容器内气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2 L恒容密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示。则下列结论正确的是
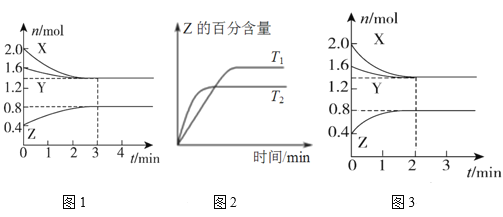
A. 容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应进行的前3min内,用X表示的反应速率v(X)=0.2 mol/(L·min)
C. 保持其他条件不变,升高温度,反应的化学平衡常数K减小
D. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(乙酰水杨酸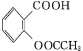 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
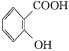 +(CH3CO)2O
+(CH3CO)2O![]()
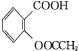 +CH3COOH
+CH3COOH
制备基本操作流程如下:
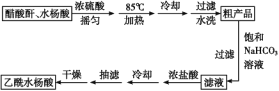
主要试剂和产品的物理常数:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)合成过程中最合适的加热方法是__________。
(2)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是______
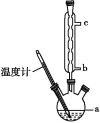
(3)另一种改进的提纯方法,称为重结晶提纯法。改进的提纯方法中加热回流的装置如图所示,仪器a的名称是____,冷凝管中冷凝水的进入口是____(填“b”或“c”),使用温度计的目的是_________
(4)检验产品中是否含有水杨酸的化学方法是_________
(5)该学习小组在实验中原料用量:2.76 g水杨酸、7.5 mL醋酸酐(ρ=1.08 g/cm3),最终称量产品m=2.92 g,则所得乙酰水杨酸的产率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振氢谱是研究有机物结构的有力手段之一,例如乙醛的结构简式为CH3-CHO,在核磁共振氢谱中有两个峰,其峰面积之比为3:1。
(1)结构式为![]() 的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
(2)某含氧有机物,其质谱图中最大质荷比为46.0,碳的质量分数为52.2%,氢的质量分数为13.0%,核磁共振氢谱中只有一个吸收峰,则该有机物的相对分子质量为___________,其结构简式是 _________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com