
 .
. 分析 反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,根据方程式计算.
解答 解:Br元素化合价升高,Mn元素化合价降低,反应中KMnO4为氧化剂,MnBr2为还原产物,HBr为还原剂,Br2为氧化产物;Br元素化合价升高1价,Mn元素化合价降低5价,反应中转移10个电子,则用双线桥标出该反应的电子转移方向和数目为 ;被氧化的HBr占总的参加反应的HBr的$\frac{5}{8}$,则被氧化的还原剂的质量是$\frac{5}{8}$×64.8g=40.5g;转移的电子的物质的量为$\frac{15.8g}{158g/mol}$×5=0.5mol;
;被氧化的HBr占总的参加反应的HBr的$\frac{5}{8}$,则被氧化的还原剂的质量是$\frac{5}{8}$×64.8g=40.5g;转移的电子的物质的量为$\frac{15.8g}{158g/mol}$×5=0.5mol;
故答案为: ;KMnO4;40.5g;0.5mol.
;KMnO4;40.5g;0.5mol.
点评 本题考查氧化还原反应的综合应用,题目难度中等,注意从化合价的角度分析,计算时注意氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+、SCN-、Cl- | B. | Fe3+、Na+、S2-、Cl- | ||
| C. | K+、H+、Cl-、AlO2- | D. | Na+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | 4HNO3═4NO2↑+O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
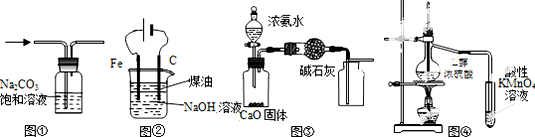
| A. | 图①除去CO2中的HCl | |
| B. | 图②装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 图③所示装置制取并收集干燥纯净的NH3 | |
| D. | 图④证明CH3CH2OH发生消去反应生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、K+、NO3-、Cl- | B. | K+、Cu2+、SO42-、HCO3- | ||
| C. | Mg2+、Cl-、SO42-、Na+ | D. | CO32-、K+、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应的离子方程式:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na与水反应的离子方程式:Na+H20═Na++OH-+H2↑ | |
| C. | FeCl3中加入统分的离子方程式:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 醋酸的电离方程式:CH3COOH═CH3COO-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外界条件相同时,放热反应的速率一定大于吸热反应的速率 | |
| B. | 化学反应中的能量变化可表现为热量的变化 | |
| C. | 反应物的总能量高于生成物的总能量时,发生放热反应 | |
| D. | CaO+H2O═Ca(OH)2反应过程中,旧键断裂吸收的能量小于新键形成释放的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com