
| A. | Ag+、K+、NO3-、Cl- | B. | K+、Cu2+、SO42-、HCO3- | ||
| C. | Mg2+、Cl-、SO42-、Na+ | D. | CO32-、K+、NO3-、Na+ |
分析 无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,酸性溶液中存在大量氢离子,
A.银离子与氯离子反应生成氯化银沉淀;
B.碳酸氢根离子与铜离子、氢离子发生反应,铜离子为有色离子;
C.四种离子之间不反应,都是无色离子,都不与氢离子反应;
D.碳酸根离子与氢离子反应.
解答 解:无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,酸性溶液中存在大量氢离子,
A.Ag+、Cl-之间反应生成难溶物氯化银,在溶液中不能大量共存,故A错误;
B.Cu2+为有色离子,H+、Cu2+与HCO3-发生反应,在溶液中不能大量共存,故B错误;
C.Mg2+、Cl-、SO42-、Na+之间不发生反应,都不与氢离子反应,都是无色离子,在溶液中能够大量共存,故C正确;
D.CO32-与氢离子反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水和1molH2的 体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气 体一定处于标准状况 | |
| D. | 在标准状况下,1molH2和O2的混合气体体积约是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn2++2OH-═Zn(OH)2↓;ZnCO3+2NaOH═Zn(OH)3↓+Na2CO3 | |
| B. | Ba2++SO42-═BaSO4↓;Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | Ag++Cl-═AgCl↓;AgNO3+NaCl═AgCl↓+NaNO3 | |
| D. | Cu+2Ag+═Cu2++2Ag↓;Cu+2AgCl═2Ag+CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
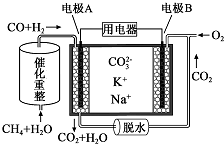
| A. | 反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4(g)+3O2(g)═2CO2(g)+2H20(l)△H=+10aKJ•mol-1 | |
| B. | C2H4(g)+3O2(g)═2CO2(g)+2H20(l)△H=-10aKJ•mol-1 | |
| C. | C2H4(g)+3O2(g)═2CO2(g)+2H20(g)△H=+10aKJ•mol-1 | |
| D. | C2H4(g)+3O2(g)═2CO2(g)+2H20(g)△H=-10aKJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,将0.02 mol•L-1的氨水与a mol•L-1的盐酸等体积混合(体积变化忽略不计),反应后溶液呈中性,则用含a的代数式表示NH3•H2O的电离常数为Kb=$\frac{a×1{0}^{-7}}{0.02-a}$ | |
| B. | 往银氨溶液中加水稀释,反应②平衡向逆反应方向移动 | |
| C. | 若往银氨溶液中加入足量的盐酸,则溶液中会产生白色浑浊 | |
| D. | 已知:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 L 0.1 mol•L-1氨水和足量的盐酸反应放出的热量等于5.73 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com