


分析 (1)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,以此解答该题;
(2)根据已知反应②③利用盖斯定律来计算反应焓变并书写热化学方程式;
(3)反应热测定实验中、保温工作是关键,中和热是稀的强酸和稀的强碱溶液反应生成1mol水放出的热量,弱电解质的电离会吸热;
(4)①燃料电池的负极上是燃料发生失电子的氧化反应;
②根据电解饱和食盐水的方程式结合燃料电池中氢气的消耗量和产生氯气的量之间的关系来计算即可;
(5)中性条件下,钢铁发生吸氧腐蚀,铁作负极,石墨作正极,正极上氧气得电子发生还原反应,要保护钢铁不受腐蚀,可以把铁设计成电解池的阴极,与电源负极相连接,设计成电解池后,石墨作阳极,阳极上氯离子放电.
解答 解:(1)根据反应:③2C(s)+2O2(g)═2CO2(g)△H=-787kJ/mol,则1molC完全燃烧生成稳定的氧化物二氧化碳放出的热量为-393.5kJ/mol,故答案为:-393.5kJ/mol;
(2)已知:②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
③2C(s)+2O2(g)═2CO2(g)△H=-787kJ/mol
CO燃烧的热化学方程式是$\frac{1}{2}$×③-②得到,即CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol;
(3)为保证液体充分混合并反应,需要搅拌器,反应热测定实验中保温工作是关键,需要使用玻璃搅拌棒,碎泡沫塑料的作用是隔热,减少反应制的热量损失,中和热是稀的强酸和稀的强碱溶液反应生成1mol水放出的热量,氨水是弱电解质,弱电解质的电离会吸热,所以相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得中和热的数值会小于57.3kJ/mol,
故答案为:环形玻璃搅拌棒;隔热,减少反应制的热量损失;小于;
(4)①氢氧燃料电池的负极上是燃料氢气发生失电子的氧化反应,即2H2-4e-+4OH=4H2O,
故答案为:2H2-4e-+4OH=4H2O;
②用该电池电解饱和食盐水,当有1molH2反应时,根据反应:2H2-4e-+4OH=4H2O,转移电子是2mol,此时生成氯气是1mol,所产生的氯气用于制备漂白粉,可以制的漂白粉的质量是0.5mol氯化钙和0.5mol次氯酸钙的混合物,质量是0.5mol×111g/mol+0.5mol×143g/mol=127g,
故答案为:127;
(5)①中性条件下,钢铁发生吸氧腐蚀,铁作负极,石墨作正极,正极上氧气得电子发生还原反应,该电池反应的总反应方程式:2Fe+2H2O+O2═2Fe(OH)2,
故答案为:2Fe+2H2O+O2═2Fe(OH)2;
②要保护钢铁不受腐蚀,可以把铁设计成电解池的阴极,与电源负极相连接,设计成电解池后,石墨作阳极,阳极上氯离子放电,即虚线框内所示位置作出的修改以及导线中电子流动的方向如下图: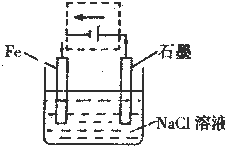 ,
,
故答案为: .
.
点评 本题综合考查学生电化学、热化学、燃料电池、以及电子守恒的计算等方面的知识,属于综合知识的考查题,注意知识的迁移和应用是关键,难度中等,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:丙烯、氯乙烯、苯 | 分子内所有原子均在同一平面 |
| B | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | 属于同一反应类型 |
| C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
| D | C5H10O2属于羧酸的同分异构体数目 | 共有4种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、K+、NO3-、Cl- | B. | K+、Cu2+、SO42-、HCO3- | ||
| C. | Mg2+、Cl-、SO42-、Na+ | D. | CO32-、K+、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的排放是形成酸雨的主要原因 | |
| B. | SO2能使酸性高锰酸钾褪色是因为SO2具有漂白性 | |
| C. | 实验室制备少量SO2可以用Na2SO3和浓硫酸加热制备 | |
| D. | SO2的收集应采用向上排空气法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
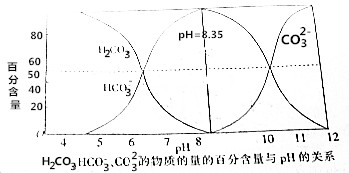
| A. | 碳酸溶液中:c(H+)>c(HCO3-) | |
| B. | pH=8.35的钠盐溶液中:c(H2CO3)+c(H+)=c(CO32-)+c(OH-) | |
| C. | 在Na2CO3和NaHCO3的混合溶液中,若c(CO32-)=c(HCO3-),则c(Na+)+c(H+)=3c(HCO3-)+c(OH-) | |
| D. | pH=12的钠盐溶液中:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com