
| A、手性催化剂主要催化一种手性分子的合成 |
| B、原子晶体的熔点一定比金属晶体的高 |
| C、元素电负性越大的原子,吸引电子的能力越强 |
| D、原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、标准状况下,0.3mol/L NaCl溶液含离子总数为0.6NA |
| B、常温常压下,18g H2O中含有的电子数总数为10NA |
| C、标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
| D、1L 2 mol/L Na2CO3溶液中含有的CO32-数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
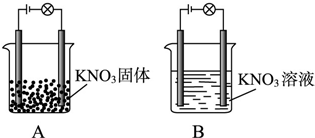 某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是
某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是| A、KNO3不是电解质 |
| B、KNO3溶液是电解质 |
| C、在KNO3溶液中,水电离出了大量的离子 |
| D、在水溶液中KNO3电离出了可以自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L该溶液中含有H2SO4的质量为9.8g |
| B、0.5L该溶液中氢离子的物质的量浓度为0.2mol/L |
| C、从1L该溶液中取出100mL,则取出溶液中H2SO4的物质的量浓度为0.01mol/L |
| D、取该溶液10mL,加水稀释至100mL后H2SO4的物质的量浓度为0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其他条件不变时通入SO2气体 |
| B、移走一部分NH4HS固体 |
| C、容器体积不变,充入N2 |
| D、压强不变时,充入N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、杀死细菌,防止水果腐烂 |
| B、吸收氧气,防止水果被氧化变色 |
| C、吸收水果产生的乙烯,防止水果早熟 |
| D、除去有害气体,防止水果被污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com